Visão geral- Práticas Essenciais
Os tumores estromais gastrointestinais (GISTs) representam menos de 1% dos tumores gastrointestinais, mas são as neoplasias mesenquimais mais comuns do trato gastrointestinal.[1] Os GISTs geralmente são encontrados no estômago ou no intestino delgado, mas podem ocorrer em qualquer lugar ao longo do trato GI e raramente têm envolvimento extra-GI. Veja a imagem abaixo.

Sinais e Sintomas
Até 75% dos GISTs são descobertos quando têm menos de 4 cm de diâmetro e são assintomáticos ou associados a sintomas inespecíficos. Eles são frequentemente diagnosticados acidentalmente durante estudos radiológicos ou procedimentos endoscópicos ou cirúrgicos realizados para investigar a doença do trato GI ou para tratar uma condição emergente, como hemorragia, obstrução ou perfuração de víscera. As manifestações clínicas dos GISTs são as seguintes:
Dor ou desconforto abdominal vago e inespecífico (mais comum)
Saciedade precoce ou sensação de plenitude abdominal
Massa abdominal palpável (rara)
Mal-estar, fadiga ou dispneia de esforço com perda significativa de sangue
Sinais focais ou generalizados de peritonite (com perfuração)
Sinais e sintomas obstrutivos de GISTs podem ser específicos do local, como segue:
Disfagia com GIST esofágico
Constipação e abdome distendido e sensível com GIST colorretal
Icterícia obstrutiva com GIST duodenal
Diagnóstico
Nenhum teste de laboratório pode confirmar ou descartar especificamente a presença de um GIST. Os exames a seguir são geralmente solicitados na investigação de pacientes que apresentam sintomas abdominais inespecíficos; dor abdominal; ou complicações como hemorragia, obstrução ou perfuração:
Contagem completa de células sanguíneas
Perfil de coagulação
Estudos de química sérica
BUN e creatinina
Testes de função hepática, valores de amilase e lipase
Tipo, tela e correspondência cruzada
albumina sérica
Estudos de imagem
Radiografia abdominal simples:
não específico
Pode ser parte de uma investigação emergente
Padrões gasosos anormais, incluindo alças intestinais dilatadas ou ar extraluminal livre, podem ser observados com obstrução ou perfuração intestinal
Série de bário e ar (duplo contraste):
Frequentemente fornece apenas informações limitadas
Geralmente pode detectar GISTs que cresceram a um tamanho suficiente para produzir sintomas
Andorinha de bário para pacientes com disfagia
Enema de bário para pacientes com constipação, diminuição do calibre das fezes ou manifestações colônicas
Os GISTs aparecem como um defeito de enchimento elevado e nitidamente demarcado
A mucosa sobrejacente normalmente tem um contorno liso, a menos que a ulceração tenha se desenvolvido.
Tomografia computadorizada de abdome e pelve:
Essencial para o diagnóstico e estadiamento de GISTs
Fornece informações abrangentes sobre o tamanho e a localização do tumor e sua relação com as estruturas adjacentes
Também pode ser usado para detectar a presença de tumores múltiplos e de disseminação metastática
As características da TC de pequenos GISTs (< 5 cm) são as seguintes[2]:
Nitidamente demarcado
Densidade homogênea
Exibem principalmente padrões de crescimento intraluminal
As características de TC de GISTs intermediários (5-10 cm) são as seguintes[2]:
Forma irregular
Densidade heterogênea
Um padrão de crescimento intraluminal e extraluminal
Sinais de agressão biológica, às vezes incluindo infiltração de órgãos adjacentes [ 2 ]
As características de TC de GISTs grandes (>10 cm) são as seguintes[2]:
Margens irregulares
Densidades heterogêneas
Comportamento localmente agressivo
Metástases à distância e peritoneais
Critérios de TC associados a histologia de alto grau e aumento da mortalidade:
Tumor maior que 11,1 cm
Contornos de superfícies irregulares
Margens indistintas
Invasão de órgãos adjacentes
Melhoria heterogênea
Metástase hepática ou peritoneal
Imagem de ressonância magnética:
Como a tomografia computadorizada, a ressonância magnética pode retratar tumores e fornecer informações sobre as estruturas circundantes
Também pode ser usado para detectar a presença de múltiplos tumores e metástases
Menos estudado que a TC para o diagnóstico de GISTs, mas parece igualmente sensível [ 3 ]
GISTs podem aparecer hipointensos em imagens ponderadas em T2
A tomografia por emissão de pósitrons com 2-[F-18]-fluoro-2-desoxi-D-glicose tem os seguintes usos:
Detecção de doença metastática
Monitoramento da resposta à terapia adjuvante (por exemplo, mesilato de imatinibe)
Endoscopia:
Frequentemente realizada no início da investigação de pacientes com sangramento GI, dor abdominal ou sintomas obstrutivos GI de GISTs
As características endoscópicas dos GISTs incluem a sugestão de uma massa submucosa lisa deslocando a mucosa sobrejacente
Ulceração ou sangramento da mucosa sobrejacente devido à necrose por pressão pode estar presente
Problemático para coleta de amostras de biópsia por causa da localização submucosa dos GISTs
Os resultados da biópsia endoscópica fornecem um diagnóstico em menos de 50% dos casos
A obtenção de uma biópsia repetida no mesmo local de uma biópsia anterior pode aumentar o rendimento diagnóstico
Ultrassonografia endoscópica (EUS):
Permite a localização de lesões e sua caracterização por ultrassonografia
Espécimes de biópsia por aspiração com agulha fina podem ser obtidos sob orientação ultrassonográfica
Os GISTs geralmente aparecem como uma massa hipoecóica na camada correspondente à muscular própria.
Complementar com TC
Mais preciso que a TC na diferenciação de lesões benignas de malignas
Permite uma avaliação mais abrangente da massa e das estruturas circundantes do que a TC
As características de EUS de GISTs malignos incluem o seguinte:
Tamanho maior que 4 cm (o único preditor independente)
Ecogenicidade heterogênea
Áreas císticas internas
Bordas irregulares nas superfícies extraluminais
As características da EUS que podem ajudar a diferenciar GISTs gástricos de leiomiomas são as seguintes[4] :
Inomogenicidade
Manchas hiperecogênicas
Um halo marginal
Ecogenicidade mais alta do que a camada muscular circundante
Os aspectos da biópsia guiada por EUS são os seguintes:
A biópsia fornece o diagnóstico definitivo
A biópsia pode ser necessária quando a terapia pré-operatória é necessária nos casos em que o tumor é irressecável ou apenas marginalmente ressecável
A biópsia pode não ser necessária se o tumor for ressecável cirurgicamente e a terapia médica pré-operatória não for necessária
Gerenciamento
A cirurgia é a terapia definitiva para pacientes com GISTs, como segue:
A extirpação cirúrgica radical e completa oferece a única chance de cura
A cirurgia também é indicada em pacientes sintomáticos com doença localmente avançada ou metastática
Reduzir lesões grandes é útil quando a terapia adjuvante é contemplada
A ressecção laparoscópica melhorou e é uma opção mais frequentemente considerada
O mesilato de imatinibe é usado no GIST da seguinte forma:
Terapia adjuvante após ressecção cirúrgica completa em pacientes com tumores de alto risco
Terapia neoadjuvante com o objetivo de redução do tumor antes da ressecção cirúrgica
Outros inibidores da tirosina quinase usados quando o imatinibe não é tolerado ou não é eficaz são os seguintes:
Sunitinibe: Menos específico que o imatinibe; aprovado como agente de segunda linha para GIST avançado
Regorafenib: Aprovado como agente de terceira linha para GIST avançado
Avapritinibe, nilotinibe e ripretinibe: aprovados como agentes de quarta linha para GIST avançado
Sorafenibe, nilotinibe e dasatinibe: agentes investigacionais de quarta linha para GIST avançado
Fundo
Os tumores estromais gastrointestinais (GISTs) representam menos de 1% dos tumores gastrointestinais, com apenas cerca de 5.000 novos casos esperados anualmente nos Estados Unidos. Os GISTs ocupam um distante terceiro lugar em prevalência atrás de adenocarcinomas e linfomas entre os tipos histológicos de tumores do trato GI. No entanto, os GISTs são as neoplasias mesenquimais mais comuns do trato GI. Os GISTs geralmente são encontrados no estômago ou no intestino delgado, mas podem ocorrer em qualquer lugar ao longo do trato GI. Raramente, os GISTs têm envolvimento extra-gastrointestinal.[5] Historicamente, essas lesões foram classificadas como leiomiomas ou leiomiossarcomas por apresentarem características de músculo liso quando examinadas à microscopia de luz. Na década de 1970, a microscopia eletrônica encontrou poucas evidências de origem muscular lisa desses tumores. Na década de 1980, com o advento da imuno-histoquímica, demonstrou-se que esses tumores não apresentavam características imunofenotípicas de células musculares lisas e sim expressavam antígenos relacionados a células da crista neural. Mazur e Clark em 1983, e Schaldenbrand e Appleman em 1984, foram os primeiros a descrever "tumores estromais" como uma entidade separada. De acordo com o trabalho de Kindblom e associados, relatado em 1998, a verdadeira célula de origem dos GISTs é uma célula-tronco mesenquimal pluripotencial programada para se diferenciar na célula intersticial de Cajal.[6] Estas são células marca-passo GI encontradas na muscular própria e ao redor do plexo mioentérico e são amplamente responsáveis por iniciar e coordenar a motilidade GI. Esse achado levou Kindblom e colaboradores a sugerir o termo tumores de células marcapasso GI.[6] Estudos adicionais descobriram que as células intersticiais de Cajal expressam KIT e são dependentes do fator de células-tronco, que é regulado por meio de KIT quinase. Talvez o desenvolvimento mais crítico que distinguiu os GISTs como uma entidade clínica única tenha sido a descoberta de mutações do proto-oncogene c-KIT nesses tumores por Hirota e colegas em 1998.[7] As mutações ativadoras do KIT são vistas em 85-95% dos GISTs. Cerca de 3-5% do restante dos GISTs KIT-negativos contêm mutações PDGFR-alfa.[8, 9, 10] A mutação PDGFR alfa parece deixar o receptor PDGFRalpha constitutivamente ativo e pode representar uma via alternativa com ativação de sinalização a jusante semelhante ao receptor KIT. A descoberta dessas mutações nos receptores redefiniu a classificação e o manejo da doença. A descoberta em 2000 de que o inibidor de tirosina quinase (TKI) imatinibe, inicialmente usado para tratar leucemia mielóide crônica, é eficaz no tratamento de GISTs metastáticos revolucionou o tratamento de pacientes com GISTs.[11] Foi demonstrado que o imatinibe tem como alvo KIT e PDGFR alfa em GIST receptor KIT positivo.[12, 13, 14, 15, 16] Essa descoberta foi celebrada como o exemplo do poder da terapia direcionada e individualizada e ajudou a concentrar muita atenção nessa doença órfã. A Food and Drug Administration (FDA) dos EUA aprovou o imatinibe para o tratamento de GIST metastático em 2002 e para a terapia adjuvante de GIST ressecado primário em 2008.[5] A FDA também aprovou os novos inibidores de tirosina quinase sunitinib e regorafenib para o tratamento de GISTs que não respondem ao imatinib.
Fisiopatologia
Os GISTs são tipicamente diagnosticados como lesões solitárias, embora em casos raros (isto é, tipo pediátrico) lesões múltiplas possam ser encontradas. Foi relatado que esses tumores variam em tamanho de menos de 1 cm a até 40 cm de diâmetro.[17] Os GISTs podem crescer intraluminalmente ou extraluminalmente em direção a estruturas adjacentes. Quando o padrão de crescimento é extraluminal, os pacientes podem apresentar a doença sem sintomas por um período prolongado e apresentar massas exogástricas muito grandes.
Aproximadamente 50-70% dos GISTs se originam no estômago. Desses, 15% ocorrem na cárdia e no fundo, 70% no corpo e 15% no antro).[18] O intestino delgado é a segunda localização mais comum, com 20-30% dos GISTs surgindo do jejunoíleo. Locais menos frequentes de ocorrência incluem cólon e reto (5-15%) e esôfago (< 5%). GISTs pancreáticos, omentais ou mesentéricos primários foram relatados, mas são muito raros.[19]
As metástases à distância tendem a aparecer tardiamente no curso da doença na maioria dos casos. Em contraste com outros tumores de tecidos moles, os locais metastáticos comuns dos GISTs são o fígado e o peritônio. O envolvimento de linfonodos é raro, ocorrendo em apenas 0-8% dos casos. No entanto, em casos raros de GIST pediátrico, os linfonodos são comumente envolvidos e metástases distantes estão presentes no momento do diagnóstico.[20] Apesar dessas metástases, esses GISTs variantes têm um curso clínico indolente.
Etiologia
A maioria dos GISTs está associada a mutações de ganho de função no exon 11 do proto-oncogene c-kit, que codifica a tirosina quinase transmembrana KIT.[21] O proto-oncogene c-kit está localizado no braço do cromossomo 4q11-12. A maioria dessas mutações é do tipo in-frame, o que permite a preservação da expressão e ativação do c-kit.
O fator de células-tronco, também chamado de fator de aço ou fator de crescimento de mastócitos, é o ligante do KIT. Em circunstâncias normais, a ativação do KIT é iniciada quando o fator de células-tronco se liga ao domínio extracelular do c-Kit. O resultado é a homodimerização dos monômeros c-Kit normalmente inativos. A autofosforilação de resíduos de tirosina intracelular ocorre então, expondo sítios de ligação para moléculas de transdução de sinal intracelular.
O que se segue é a ativação de uma cascata de sinalização que envolve a fosforilação de várias proteínas-alvo a jusante, incluindo MAP quinase, RAS e outras. Por fim, o sinal é transduzido para o núcleo, resultando em atividade mitogênica e transcrição de proteínas.
Na maioria dos GISTs, o KIT é constitutivamente fosforilado e não requer fator de células-tronco para iniciar a sequência de homodimerização e autofosforilação do c-Kit. Isso é chamado de ativação independente de ligante. A transdução aumentada de sinais proliferativos para o núcleo favorece a sobrevivência e a replicação celular em detrimento da dormência e da apoptose, levando à tumorigênese.[22]
Embora 95% dos GISTs sejam KIT positivos, 5% dos GISTs não têm expressão de KIT detectável. Em uma proporção desses GISTs KIT-negativos, ocorrem mutações no gene PDGFRA em vez de KIT. A imunocoloração com PDGFRA demonstrou ser útil na discriminação entre GISTs KIT-negativos e outras lesões mesenquimais gastrointestinais.
Mutações BRAF e proteína quinase C theta (PKCtheta) também foram relatadas em uma pequena proporção de GISTs sem KIT/PDGFRA. Estudos iniciais sugerem que GISTs de mutações BRAF têm predileção pelo intestino delgado e não estão associados a alto risco de malignidade.[23] Mutações do gene NF2 também foram relatadas em GISTs, mas essas mutações não parecem ser parte integrante da patogênese do GIST.[24]
Uma pequena minoria de GISTs está associada a síndromes hereditárias. Os GISTs familiares são caracterizados por mutações germinativas hereditárias em KIT ou PDGFRA e achados adicionais, como os seguintes:
hiperpigmentação cutânea
Síndrome do intestino irritável
Disfagia
Doença diverticular
Dos indivíduos com essas mutações germinativas, 90% podem desenvolver GISTs aos 70 anos de idade. Pacientes com mutações germinativas autossômicas dominantes de KIT podem apresentar múltiplos GISTs em idade precoce.[25] No entanto, os GISTs familiares têm resultados favoráveis e não parecem estar associados a uma sobrevida reduzida. Não há dados que suportem a terapia preventiva em pacientes com essas mutações germinativas.
Além disso, as seguintes síndromes estão ligadas a GISTs[25] :
Tríade de Carney - GISTs gástricos, paraganglioma e condromas pulmonares (estes podem ocorrer em diferentes idades); afeta principalmente mulheres jovens [ 26 ]
Síndrome de Carney-Stratakis - GIST e paraganglioma
Neurofibromatose tipo 1 - GIST de tipo selvagem, muitas vezes multicêntrico, predominantemente localizado no intestino delgado
Epidemiologia
Frequência
Cerca de 5.000 novos casos de GISTs são diagnosticados anualmente nos Estados Unidos. De acordo com o banco de dados de Vigilância, Epidemiologia e Resultados Finais (SEER), a incidência anual ajustada por idade de GISTs aumentou de 0,55 por 100,000 habitantes em 2001 para 0,78/100,000 em 2011.[27]
Os dados sobre a frequência mundial são limitados, mas, em geral, os GISTs constituem 1-3% de todas as malignidades gástricas. Estudos de base populacional da Islândia, Holanda, Espanha e Suécia relatam taxas de incidência anual variando de 6,5 a 14,5 casos por milhão.[28, 29, 30, 31]
Mortalidade/Morbidade
De acordo com dados do SEER de 2001-2011, as taxas de sobrevida geral em 5 anos para pacientes com GISTs são 77% para aqueles com doença localizada no momento do diagnóstico, 64% para aqueles com doença regional e 41% para aqueles com doença metastática.[27]
Os GISTs gástricos têm um prognóstico melhor do que os GISTs do intestino delgado de tamanho e taxa mitótica semelhantes. Em geral, os GISTs gástricos prenunciam um prognóstico muito melhor do que o adenocarcinoma do estômago.
Mesmo após a ressecção completa do GIST primário, pelo menos 50% dos pacientes desenvolvem recorrência ou metástase, em um tempo médio de recorrência de 2 anos. Essa alta taxa de recorrência ocorre no contexto de uma taxa de sobrevida global de 5 anos de 50%.
GISTs maiores estão associados a complicações como hemorragia gastrointestinal, obstrução gastrointestinal e perfuração intestinal. Pacientes com GISTs avançados que estão recebendo terapia com inibidores de tirosina quinase podem desenvolver hemorragia intraluminal ou intraperitoneal relacionada ao tumor, ruptura, fístula ou obstrução, exigindo cirurgia de emergência.
Dados demográficos relacionados a raça, sexo e idade
Uma revisão do banco de dados SEER de 2001-2011 constatou que os GISTs eram mais comuns em não hispânicos do que em hispânicos (taxa de taxa [RR] = 1,23) e em negros (RR = 2,07) ou asiáticos/nativos das ilhas do Pacífico (RR = 1,50) do que em brancos. Os GISTs também foram mais comuns em homens do que em mulheres (RR=1,35). A incidência de GISTs aumentou com a idade, atingindo o pico entre 70-79 anos de idade.[27]
Maior idade ao diagnóstico, sexo masculino, raça negra e estágio avançado ao diagnóstico foram fatores de risco independentes de pior sobrevida global, na análise multivariada. Essas características, junto com o ano anterior de diagnóstico, também foram fatores de risco independentes de pior sobrevida específica para GIST.[27]
Prognóstico
Os GISTs manifestam uma ampla variedade de comportamento clínico, desde tumores indolentes de crescimento lento até cânceres malignos agressivos com propensão a invadir órgãos adjacentes, metastizar para o fígado e recorrer localmente no abdome. A apresentação clínica fornece a evidência mais clara para distinguir o comportamento benigno do maligno. A análise histológica de biópsia ou espécimes cirúrgicos fornece medidas objetivas para o diagnóstico e ajuda a prever o comportamento clínico.
Os fatores prognósticos predominantes em pacientes com GISTs incluem o tamanho do tumor, a localização do tumor e a taxa mitótica.[32, 33, 34] A eles pode ser adicionada a capacidade ou incapacidade de obter margens de ressecção completamente negativas. As seguintes características parecem ser as mais preditivas de comportamento agressivo em GISTs:
Taxa mitótica superior a 5 mitoses por 50 campos de alta potência (HPFs)
Tamanho maior que 5 cm e 10 cm, que apresentam potencial maligno moderado e alto, respectivamente [ 17 ]
Localização (os GISTs do intestino delgado de tamanho e taxa mitótica comparáveis são geralmente mais agressivos que os GISTs gástricos)
Como não existe um sistema de estadiamento padronizado para tumores estromais do trato GI e a maioria das séries é pequena e heterogênea, a comparação das diferentes taxas de sobrevida publicadas é difícil. No entanto, vários relatos de taxas de sobrevida em 5 anos após ressecção R0 para GISTs variam de 32 a 93%. Em grandes séries, essa taxa é de cerca de 50-60%.
A sobrevida média após a ressecção paliativa é de cerca de 10 meses, com uma taxa de sobrevida em 5 anos de até 10%. Essas taxas melhoram com a adição de imatinibe.[35, 36, 32, 33] A disparidade entre os pacientes que apresentam doença primária localizada (sobrevida média de 5 anos) e aqueles que apresentam metástase ou doença recorrente (sobrevida média de 10-20 meses ) é grande.
Infelizmente, nenhuma determinação absoluta pode ser feita porque mesmo pequenas lesões com baixas taxas mitóticas podem metastatizar ou se comportar de maneira localmente agressiva. Em 2002, Fletcher e colegas propuseram o seguinte sistema de classificação para definir o risco de comportamento agressivo ou maligno em GISTs[37] :
Risco muito baixo: tamanho < 2 cm e < 5 mitoses/50 HPFs
Baixo risco: 2-5 cm e < 5/50 HPFs
Risco intermediário: < 5 cm e 6-10/50 HPFs ou 5-10 cm e < 5/50 HPFs
Alto risco: >5 cm e >5/50 HPFs ou >10 cm e qualquer taxa mitótica ou qualquer tamanho e >10/50 HPFs
Em 2009, Gold et al, do Memorial Sloan-Kettering Cancer Center (MSKCC), desenvolveram um nomograma que usa tamanho, local e índice mitótico do tumor para prever a sobrevida livre de recidiva após ressecção de GIST primário localizado.[38]
Os critérios da NCCN para estratificação de risco de GIST primário não foram incorporados ao estadiamento AJCC, mas podem ser mais úteis na determinação do risco individual de doença progressiva, após ressecção com margem negativa. A estratificação é por índice mitótico (≤5 versus >5 por 50 HPF) e depois dividida por tamanho do tumor (≤2 cm vs >2 cm; ≤5 cm vs >5 cm; ≤10 cm vs >10 cm) e tumor localização (gástrica e não gástrica).[39]
GISTs gástricos maiores que 10 cm, mas com um índice mitótico HPF de 5/50 ou menos, têm apenas 12% de risco de doença progressiva, apesar de 34-52% de risco de doença progressiva em outras localizações tumorais. No entanto, GISTs gástricos maiores que 10 cm com alto índice mitótico (>5/50 HPFs) têm um risco igualmente alto de doença progressiva (86%) como GISTs em outros locais (71-90%).[39]
O status mutacional tem significado prognóstico e impacto na resposta à terapia com inibidores de tirosina quinase. Em ensaios clínicos randomizados, a presença de uma mutação do exon 11 do KIT foi associada a uma melhor resposta, sobrevida livre de progressão e taxas de sobrevida global do que GISTs mutantes do exon 9 do KIT. O risco de progressão e morte aumentou em pacientes sem mutações KIT ou PDG-FRA detectáveis.[12]
Outros fatores encontrados para ter um impacto negativo no prognóstico são os seguintes:
Ruptura do tumor durante a operação
Envolvimento de margens histológicas
Envolvimento dos linfonodos
Em uma análise de 4.694 pacientes com GISTs localizados do National Cancer Data Base, Sineshaw e colegas descobriram que os pacientes tratados com terapia adjuvante tinham um risco 46% menor de morte do que os pacientes tratados apenas com cirurgia. maior que 10 cm.[40]
Educação paciente
Os pacientes devem ser instruídos sobre o maior número possível de aspectos da doença, incluindo medidas e opções diagnósticas e terapêuticas. GIST Support International produziu um livreto de educação do paciente intitulado Compreendendo seu relatório de patologia GIST.
Mais importante ainda, os pacientes devem ser informados sobre a necessidade de acompanhamento clínico próximo ao longo da vida, mesmo após a ressecção completa da doença. Enfatize que os GISTs têm propensão a recorrer.
Apresentação
História
Muitos tumores estromais gastrointestinais (GISTs) são descobertos acidentalmente durante procedimentos endoscópicos ou cirúrgicos. No Japão, a triagem em massa para adenocarcinoma gástrico com endoscopia digestiva alta levou a um aumento nos achados incidentais de GISTs assintomáticos.
Outros GISTs são detectados em estudos radiológicos realizados para investigar manifestações variadas de doenças do trato GI ou procedimentos realizados para tratar uma condição emergente, como hemorragia ou obstrução. Em um estudo de base populacional, o tamanho mediano do tumor de GISTs que foram detectados como achados incidentais foi de 2.7 cm, contra 8.9 cm para aqueles encontrados com base em sintomas.[31]
Os GISTs podem produzir sintomas secundários a hemorragia ou obstrução. A hemorragia digestiva alta é a manifestação clínica mais comum dos GISTs, manifestando-se como hematêmese ou melena em 40-65% dos pacientes. O sangramento ocorre devido à necrose por pressão e ulceração da mucosa sobrejacente com hemorragia resultante de vasos rompidos. Pacientes que tiveram perda significativa de sangue podem relatar mal-estar, fadiga ou dispnéia de esforço.
A obstrução pode resultar do crescimento intraluminal de um tumor endofítico ou da compressão luminal de uma lesão exofítica. Os sintomas obstrutivos podem ser específicos do local (por exemplo, disfagia com GIST esofágico, constipação com GIST colorretal, icterícia obstrutiva com tumor duodenal). Outros sintomas geralmente estão associados a uma massa abdominal crescente e podem incluir o seguinte:
Dor abdominal
Anorexia
Náusea
Vômito
Perda de peso
Plenitude epigástrica
saciedade precoce
Exame físico
O exame físico raramente demonstra quaisquer achados significativos. Em alguns casos, o exame pode identificar uma massa palpável no abdome. Massas palpáveis são tipicamente detectadas em pacientes com crescimento tumoral extraluminal.
Outros pacientes podem apresentar achados físicos inespecíficos associados à perda de sangue gastrointestinal, obstrução intestinal ou perfuração intestinal e formação de abscesso.
Pacientes com sangramento gastrointestinal significativo podem apresentar sinais vitais anormais ou choque evidente. Em outros, o teste de sangue oculto nas fezes pode ser positivo.
Os achados físicos associados à obstrução intestinal podem incluir um abdômen distendido e sensível. A obstrução duodenal envolvendo a ampola pode estar associada a icterícia e, raramente, até mesmo a uma vesícula biliar palpável e distendida.
Se ocorreu perfuração, sinais focais ou generalizados de peritonite estão presentes.
Considerações de diagnóstico
Ao avaliar pacientes com suspeita de GISTs, inclua as seguintes condições no diagnóstico diferencial:
hemangioendotelioma epitelióide
Fibromatose
Linfoma
Melanoma metastático
Schwannoma
Leiomioma
O diagnóstico diferencial para tumores estromais gástricos inclui lesões benignas, como leiomioma verdadeiro, schwannoma, lipoma, pâncreas ectópico e sarcomas.[41] Outras possíveis lesões incluem o muito mais comum adenocarcinoma gástrico e outros tumores malignos submucosos raros, como linfoma e carcinóide.
Não raramente, pacientes com GISTs do estômago apresentam uma grande massa no epigástrio ou no quadrante superior esquerdo. Nesses casos, o diagnóstico diferencial pode incluir massas com origem em outros órgãos, como fígado, baço, pâncreas, glândula adrenal esquerda ou retroperitônio.
Diagnósticos Diferenciais
Neoplasias Benignas do Intestino Delgado
Dermatofibroma
Câncer de intestino
Tumores do Estroma Gastrointestinal (Leiomioma/Leiomiossarcoma) Imagiologia
Leiomiossarcoma Intestinal
lipomas
Neoplasias Malignas do Intestino Delgado
Tumor Fibroso Solitário
Estudos de Laboratório
Nenhum teste de laboratório pode confirmar ou descartar especificamente a presença de um tumor estromal gastrointestinal (GIST). Os exames a seguir são geralmente solicitados na investigação de pacientes que apresentam sintomas abdominais inespecíficos; dor abdominal; ou achados que podem ser devidos a complicações de GISTs, como hemorragia, obstrução ou perfuração:
Contagem completa de células sanguíneas
Perfil de coagulação
Estudos de química sérica
BUN e creatinina
Testes de função hepática
Valores de amilase e lipase
Tipo de sangue, triagem e prova cruzada
albumina sérica
Os GISTs não estão associados à elevação de nenhum marcador tumoral sérico. No entanto, dependendo da localização, tamanho e aparência do tumor nos estudos de imagem, pode ser apropriado realizar ensaios de marcadores tumorais, como os seguintes para outras neoplasias abdominais:
Antígeno de câncer 19-9 (CA19-9)
Antígeno carcinoembrionário (CEA)
CA-125
Alfa fetoproteína (AFP)
Estudos de imagem
Os estudos de imagem usados na investigação de GISTs incluem o seguinte:
Radiografia
ultrassonografia
Tomografia computadorizada (TC)
Ressonância magnética (RM)
Tomografia por emissão de pósitrons (PET)
Radiografia
A radiografia simples de abdome é inespecífica, mas pode ser solicitada como parte da investigação de um paciente que se apresenta de forma emergencial com possível obstrução ou perfuração intestinal. Padrões gasosos anormais, incluindo alças intestinais dilatadas ou ar extraluminal livre, são exemplos de achados que podem ser detectados nessas situações clínicas.[42]
Série de bário e ar (duplo contraste)
A série radiográfica de duplo contraste geralmente pode detectar GISTs que cresceram a um tamanho suficiente para produzir sintomas. A escolha de realizar uma deglutição de bário, enema de bário ou ambos depende da apresentação clínica do paciente. Por exemplo, pacientes cuja sintomatologia primária inclui disfagia devem ter uma ingestão de bário. Aqueles que apresentam constipação, diminuição do calibre das fezes ou outros sinais e sintomas relacionados ao cólon devem fazer um enema opaco.
Nesses estudos de contraste, os GISTs aparecem como um defeito de preenchimento nitidamente demarcado e elevado em comparação com a mucosa circundante.[43] Normalmente, o contorno da mucosa sobrejacente é liso, a menos que a ulceração tenha se desenvolvido devido ao crescimento do tumor subjacente.
Embora esses estudos possam produzir imagens impressionantes, frequentemente as informações que eles fornecem são limitadas. Outras modalidades listadas abaixo têm sensibilidade igual ou maior e podem fornecer mais informações sobre o estado das estruturas circundantes.
Enteróclise
Como costuma acontecer com outras lesões do intestino delgado, os GISTs no intestino delgado podem ser difíceis de diagnosticar e localizar. A enteróclise permite a aplicação de contraste no intestino delgado para que não fique muito diluído quando atingir a área em questão. Isso pode ajudar a definir melhor os GISTs do intestino delgado.
Ultrassonografia
A aparência ultrassonográfica dos GISTs varia dependendo do tamanho da lesão e da presença ou ausência de necrose dentro da massa. Além disso, a ulceração ou necrose da mucosa sobrejacente pode alterar as características ultrassonográficas do tumor.
A ultrassonografia transcutânea provavelmente não é a escolha ideal para imagens dessas lesões, a menos que a massa tenha atingido um tamanho bastante grande. Como os GISTs estão associados a vísceras cheias de ar, a qualidade da imagem é frequentemente degradada por gases intestinais intervenientes.
As melhores imagens ultrassonográficas dessas lesões são adquiridas durante a ultrassonografia endoscópica (ver Procedimentos).
Tomografia computadorizada
A tomografia computadorizada com material de contraste intravenoso e oral é uma etapa necessária no diagnóstico e estadiamento de GISTs.[25] Ele fornece informações abrangentes sobre o tamanho e localização do tumor e sua relação com as estruturas adjacentes. A tomografia computadorizada também pode ser usada para detectar a presença de múltiplos tumores e pode fornecer evidências de disseminação metastática.
Ghanem e colegas descreveram as características CT dos GISTs com base no tamanho, como segue[2]:
Pequeno (< 5 cm): Massas bem demarcadas, homogêneas, exibindo principalmente padrões de crescimento intraluminal
Intermediário (5-10 cm): Forma irregular, densidade heterogênea, padrão de crescimento intraluminal e extraluminal e sinais de agressão biológica, às vezes incluindo infiltração de órgãos adjacentes
Grande (>10 cm): Margens irregulares, densidades heterogêneas, comportamento localmente agressivo e metástases à distância e peritoneais
Em pacientes com GISTS gástricos, a massa gástrica pode ser detectada com origem na parede gástrica, conforme ilustrado na imagem abaixo. Em alguns casos, no entanto, o local de origem do órgão não é claro na tomografia computadorizada. A tomografia computadorizada também pode ser usada para avaliar a invasão do tumor em estruturas adjacentes e a presença de metástases intra-abdominais. A identificação da doença à distância é importante, pois metade dos pacientes que inicialmente se apresentam com um GIST têm metástases à distância (dois terços deles têm envolvimento hepático). Imagem de ressonância magnética Como a tomografia computadorizada, a ressonância magnética pode representar o tumor ou tumores e fornecer informações sobre as estruturas circundantes. Também pode ser usado para detectar a presença de múltiplos tumores e metástases. A RM pode ser um complemento especialmente útil da TC na avaliação de grandes tumores que apresentam componentes necróticos e hemorrágicos. As porções sólidas do tumor mostram baixa intensidade nas imagens T1 e alta intensidade nas imagens T2, com realce da massa quando o gadolínio intravenoso é administrado. A intensidade do sinal dos componentes hemorrágicos do tumor pode variar de alta a baixa, dependendo da idade da hemorragia. Tomografia por emissão de pósitrons A PET com 2-[F-18]-fluoro-2-desoxi-D-glicose (18-FDG PET) tem sido recomendada para detectar doença metastática em pacientes com GISTs. No entanto, é útil principalmente para a detecção precoce da resposta do tumor a terapias adjuvantes, como o mesilato de imatinibe.[44]
Procedimentos
Endoscopia
A endoscopia é frequentemente realizada no início da investigação de pacientes com GISTs, para avaliar sangramento GI, dor abdominal ou sintomas obstrutivos GI. No entanto, a endoscopia geralmente não é necessária na investigação de pacientes com lesões sugestivas na TC.
As características endoscópicas dos GISTs incluem a sugestão de uma massa submucosa firme, lisa e amarelada deslocando a mucosa sobrejacente. Alguns tumores podem estar associados a ulceração ou sangramento da mucosa sobrejacente devido à necrose por pressão. Veja a imagem abaixo.
Esses tumores podem passar despercebidos na endoscopia devido ao seu frequente crescimento submucoso e extraluminal. Se houver suspeita do diagnóstico antes da endoscopia, uma ultrassonografia endoscópica pode ser realizada para melhor caracterizar e ajudar a confirmar a origem da lesão (quando o local do órgão do tumor não é claramente evidente na tomografia computadorizada), mesmo que não seja visível endoscopicamente.
Ultrassonografia endoscópica
A ultrassonografia endoscópica (EUS) pode ser uma ferramenta valiosa no diagnóstico e avaliação pré-operatória de GISTs gástricos quando o diagnóstico ou localização é duvidoso, e a EUS é geralmente a modalidade preferida para facilitar a biópsia da lesão, quando a biópsia é indicada. No entanto, a EUS geralmente não é necessária para exames pré-operatórios.[4, 45]
Se a localização da lesão for duvidosa, a EUS pode ajudar a planejar a abordagem cirúrgica (por exemplo, demonstrando que uma lesão gástrica proximal na tomografia computadorizada está longe o suficiente da junção gastroesofágica para permitir a ressecção local em cunha em oposição à gastrectomia total). A EUS também pode demonstrar a localização submucosa do tumor e pode definir seu tamanho, bordas e padrão ecoico.
Em geral, as características ultrassônicas de uma massa suspeita de malignidade são as seguintes:
Tamanho grande
Bordas extraluminais irregulares
Presença de espaços císticos e focos ecogênicos
Biópsia pré-operatória
Embora o diagnóstico muitas vezes possa ser feito por meio de biópsia guiada por ultrassonografia, o uso da biópsia é controverso em uma lesão primária ressecável suspeita de GIST. Geralmente, a biópsia não é recomendada nesse cenário.[39] A biópsia de um GIST, que tende a ser mole e frágil, pode causar hemorragia intratumoral ou mesmo ruptura e pode aumentar o risco de disseminação tumoral. Independentemente dos resultados da biópsia, a ressecção cirúrgica é normalmente necessária para o tratamento e para o diagnóstico definitivo.
No entanto, a biópsia é necessária no cenário de suspeita de doença metastática ou quando o tratamento neoadjuvante de um GIST ressecável limítrofe está sendo considerado. A biópsia também pode ser importante quando o diagnóstico de GIST está em dúvida, como quando há dúvida sobre a natureza submucosa do tumor ou quando o tumor apresenta características atípicas na endoscopia ou na ultrassonografia endoscópica. Em pacientes específicos, como aqueles com alto risco operatório com pequenas lesões de aparência benigna e sintomas mínimos ou inexistentes, o diagnóstico tecidual pode orientar a tomada de decisão.
A biópsia endoscópica é o procedimento recomendado para a obtenção de um diagnóstico histológico pré-operatório. A biópsia endoscópica guiada por ultrassom pode alcançar um diagnóstico histológico correto em mais de 80% dos casos. Sem orientação por ultrassom, a biópsia endoscópica leva a um diagnóstico correto em menos de 50% dos pacientes; biópsias não guiadas podem perder o tumor e mostrar apenas tecido mucoso, ou fornecer amostras que contenham muito pouco tecido tumoral para estabelecer se o tumor é maligno.
Espécimes de biópsia também podem ser obtidos por via percutânea sob orientação de TC ou ultrassonografia.[46] Considere esta abordagem em pacientes selecionados quando a biópsia endoscópica for impossível de realizar ou os resultados forem negativos.
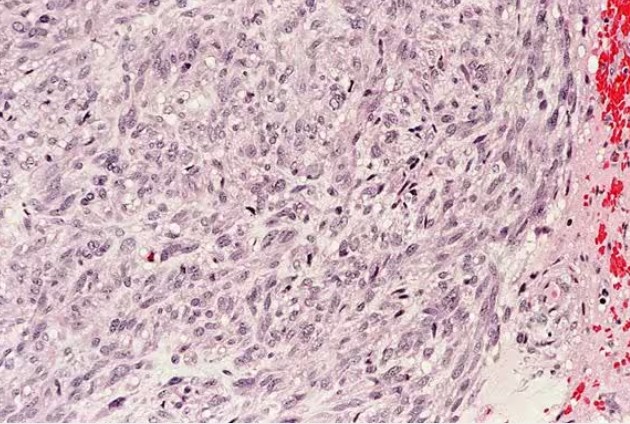
Achados Histológicos
A morfologia celular conforme visualizada por microscopia de luz pode ser variável. Na maioria das vezes, os tumores são altamente celulares e compostos por células fusiformes que se assemelham ao tecido muscular liso, conforme ilustrado na primeira imagem abaixo. No entanto, esse aspecto histológico não é uniforme. Um tumor semelhante com um componente epitelióide predominante foi historicamente diagnosticado como leiomioblastoma, conforme representado na segunda imagem abaixo. Esta variante é ocasionalmente associada a uma condição bem definida chamada síndrome de Carney.
Fotomicrografia de tumor estromal gastrointestinal (GIST) corado com hematoxilina e eosina (H&E) e ampliado 40X. Observe a folha sólida de células fusiformes.
Fotomicrografia de tumor estromal gastrointestinal (GIST) gástrico corado com hematoxilina e eosina (H&E) e ampliado 400X. Este tumor estromal demonstra células fusiformes com características epitelioides.
Fatores histológicos importantes a serem considerados na avaliação desses tumores são os seguintes:
índice mitótico
Celularidade
Necrose
Atipia nuclear e relação núcleo-citoplasma
Forma da célula
Quantidade de estroma
vascularidade
Investigações de GISTs por imuno-histoquímica e microscopia eletrônica (parâmetros ultraestruturais) revelam variabilidade fenotípica que inclui características mióides, neurais e indeterminadas.[47] O estudo de GISTs por métodos de imuno-histoquímica revela a expressão de CD117 e outros vários antígenos, como os seguintes:
Nestin (90-100% de positividade)
CD34 (70% de positividade)
CD44 [ 48 ]
vimentina
Desmin
Actina específica do músculo
actina de músculo liso
proteína S-100
neurofilamento
Enolase neuroespecífica
Produto do gene da proteína 9.5 (PGP9.5)
O CD117 desempenha um papel importante nos critérios diagnósticos específicos mais recentes para GISTs. CD117 (proteína c-kit) é um receptor de fator de crescimento com atividade tirosina-quinase e é um produto do proto-oncogene c-kit. O CD117, embora não específico do tumor, é expresso em todos os GISTs, mas não em tumores de músculo liso verdadeiros e tumores neurais. O CD117 tornou-se uma ferramenta muito importante na diferenciação de GIST de outros tumores mesenquimais GI.[49, 50] A coloração positiva de CD117 em um tumor GI de células fusiformes é diagnóstica para GIST, conforme ilustrado na imagem abaixo. O CD34 é outro marcador diagnóstico importante. É detectado em aproximadamente 70% dos GISTs, e sua presença pode indicar uma maior probabilidade de um fenótipo maligno. O CD44 é expresso de forma variável por GISTs, mas foi demonstrado que sua expressão se correlaciona com um melhor prognóstico. Encenação Não há consenso sobre um sistema de estadiamento uniforme e nenhuma das classificações atualmente utilizadas é totalmente satisfatória. A maioria dos sistemas de estadiamento emprega a classificação TNM (tumor-nodo-metástase) do American Joint Committee on Cancer (AJCC), que utiliza os três preditores de sobrevida mais importantes: tamanho do tumor, grau histológico e presença ou ausência de doença metastática distante.[51] Os critérios da NCCN para estratificação de risco de GIST primário não foram incorporados ao estadiamento AJCC, mas podem ser mais úteis na determinação do risco individual de doença progressiva, após ressecção com margem negativa. A estratificação é por índice mitótico (≤5 versus > 5 por 50 campos de alta potência [HPF]) e depois dividida pelo tamanho do tumor (≤2 cm vs > 2 cm; ≤5 cm vs > 5 cm; ≤10 cm vs > 10 cm) e localização do tumor (gástrico e não gástrico).[39] GISTs gástricos maiores que 10 cm, mas com um índice mitótico de 5/50 HPF ou menos, apresentam apenas 12% de risco de doença progressiva, em comparação com 34-52% de risco de doença progressiva em outras localizações tumorais. No entanto, GISTs gástricos maiores que 10 cm com alto índice mitótico (> 5/50 HPF) têm um risco igualmente alto de doença progressiva (86%) como GISTs em outros locais (71-90%).[39] Muitos estudos mostraram que o diâmetro do tumor maior que 5 cm está associado ao aumento do risco de malignidade. Entretanto, a relação do tamanho com o potencial maligno pode ser gradual, sem um ponto de corte claro. Um alto índice mitótico (> 5/50 HPF) geralmente significa doença altamente maligna. No entanto, um baixo índice mitótico nem sempre está associado a um curso benigno. Até 25% dos tumores com índice mitótico < 5/50 HPF podem manifestar um comportamento biológico agressivo. Outros parâmetros histológicos, como celularidade, atipia e necrose, também são levados em consideração. A classificação TNM para GISTs é fornecida na Tabela 1, abaixo. Tabela 1. Classificação TNM para tumores estromais gastrointestinais


Os grupos de estágio anatômico/prognóstico para GISTs gástricos e de intestino delgado são mostrados nas tabelas 2 e 3, abaixo. Tabela 2. Estágio anatômico/grupos prognósticos para GISTs gástricos


Tabela 3. Estágio anatômico/grupos prognósticos para GISTs do intestino delgado


Tratamento
Considerações de Abordagem
Quando viável, a ressecção cirúrgica é o tratamento de escolha para tumores estromais gastrointestinais (GISTs) e oferece a única chance de cura. A terapia médica é indicada nos quatro cenários a seguir [5, 39, 52, 53]:
No pré-operatório, para possibilitar a ressecabilidade ou diminuir a morbidade ao encolher o tumor
Após a cirurgia, para diminuir a recorrência
Na doença metastática, como tratamento definitivo
Na doença recorrente e irressecável, como tratamento definitivo
A terapia médica consiste em inibidores de tirosina quinase (TKI), sendo o agente de primeira linha mais comumente recomendado o mesilato de imatinibe (Gleevec).
Cuidados médicos
O imatinibe é a escolha padrão para a terapia adjuvante de GISTs, bem como para o tratamento de GISTs inoperáveis e metastáticos localmente avançados, mas os GISTs variam em sua resposta ao imatinibe.[25, 39] O uso de imatinibe pode ser guiado pela genotipagem de KIT e Mutações PDGFRA.[25, 54] O imatinibe mostra a maior atividade em GISTs que contêm a mutação no exon 11 do KIT; aproximadamente 90% desses pacientes respondem. As mutações Ala502_Tyr503dup do exon 9 do KIT, que ocorrem predominantemente em GISTs intestinais, são menos sensíveis ao imatinibe; aproximadamente 50% respondem. Para melhorar a resposta nesses pacientes, um regime recomendado é iniciar o imatinibe na dose padrão de 400 mg por dia e depois aumentar para 800 mg por dia, se tolerado, durante aproximadamente 1 mês.[55, 56]
A maioria dos GISTs com mutações no gene PDGFRA responde ao imatinibe, com exceção notável daqueles com D842V.[39] Há consenso de que pacientes cujos GISTs apresentam a mutação PDGFRA D842V não devem ser tratados com nenhuma terapia adjuvante, dada a falta de sensibilidade desse genótipo; no entanto, o avapritinibe neoadjuvante pode ser considerado em tais pacientes se a cirurgia R0 não for viável ou se houver probabilidade de resultar em sequelas importantes.[25]
Os GISTs com mutações no gene da succinato desidrogenase (SDH) que resultam em deficiência de SDH também são geralmente resistentes à terapia com TKI, embora teoricamente esses tumores possam ter maior sensibilidade aos TKIs com um mecanismo de ação antiangiogênico proeminente (por exemplo, sunitinibe, regorafenibe). [57] A ressecção cirúrgica é a base do tratamento para tumores localizados nesses pacientes, mas a recorrência é comum. Ensaios clínicos de agentes sistêmicos para tratamento de GIST avançado deficiente em SDH estão atualmente em andamento.[58] Recomenda-se o encaminhamento desses pacientes para centros especializados.[57]
O imatinibe vem em comprimidos de 100 mg e pode, portanto, ser administrado em doses graduadas (100, 200, 300, 400, 500, 600, 700, 800 mg) enquanto se monitora as respostas ao tratamento. As reações adversas do imatinibe são controláveis e incluem edema, erupção cutânea, diarreia, náusea, dor abdominal e fadiga. A interrupção do tratamento ou redução da dose pode ser necessária em pacientes que desenvolvem hepatotoxicidade grave ou outras reações adversas graves. Em pacientes que reduziram a dose devido a toxicidades graves, foram observadas respostas com uma dose tão baixa quanto 100 mg.
Em pacientes que receberam imatinibe no pré-operatório e cujo GIST foi completamente ressecado, a National Comprehensive Cancer Network (NCCN) recomenda considerar a continuação do imatinibe no pós-operatório. Embora a duração do tratamento nesse cenário não tenha sido estudada em estudos randomizados, os dados dão suporte à continuação por 3 anos após a cirurgia.[39]
O uso de imatinibe como terapia adjuvante para prevenir a recorrência de GIST primário foi aprovado pela Food and Drug Administration (FDA) dos EUA em 2008.[59]
Em 2012, o FDA ampliou a duração aprovada do uso de 1 ano para 3 anos após a remoção cirúrgica de GISTs positivos para CD117. A aprovação foi baseada em um estudo randomizado em 400 pacientes com KIT (CD117)-GISTs positivos, que descobriu que na mediana de 5 anos de acompanhamento, a sobrevida global foi maior em pacientes tratados por 3 anos do que naqueles tratados por 1 ano (92% vs 82%; taxa de risco [HR], 0,45; P = 0,019); A sobrevida livre de recidiva em 5 anos também foi significativamente superior (65.6% vs 47.9%; HR, 0.46; P< 0.0001).[60]
A European Society for Medical Oncology (ESMO) alerta que a avaliação da resposta ao tratamento é complexa e que a progressão precoce, em particular, deve ser confirmada por uma equipe experiente. Na maioria dos casos, a atividade antitumoral é indicada pelo encolhimento do tumor, mas, em alguns casos, a resposta do tumor é indicada apenas por uma diminuição na densidade do tumor, ou a diminuição da densidade pode preceder o encolhimento tardio do tumor.[25]
Mesmo um aumento no tamanho do tumor pode indicar resposta do tumor se a densidade do tumor na tomografia computadorizada for diminuída. Mesmo o aparecimento de lesões aparentemente novas pode ser decorrente de lesões pré-existentes que se tornam mais evidentes quando se tornam menos densas.[25]
Portanto, a ESMO recomenda usar o tamanho e a densidade do tumor na tomografia computadorizada, ou alterações consistentes na ressonância magnética ou ultrassom com contraste, como critérios para a resposta do tumor. A varredura com 2-[F-18]-fluoro-2-desoxi-D-glicose (18-FDG PET) provou ser altamente sensível na avaliação precoce da resposta do tumor e pode ser útil em casos em que há dúvida ou quando a previsão precoce de a resposta é particularmente útil (por exemplo, tratamentos citorredutores pré-operatórios). Entretanto, uma pequena proporção de GISTs não apresenta captação de FDG.
A ausência de progressão do tumor após 6 meses de tratamento também equivale a uma resposta do tumor, de acordo com a ESMO. Por outro lado, a progressão do tumor pode ocorrer sem alterações no tamanho do tumor; tais casos podem ser indicados pelo aumento da densidade nas lesões tumorais. Um padrão de progressão típico é o “nódulo dentro da massa”, no qual uma porção de uma lesão responsiva torna-se hiperdensa.
No cenário de GIST metastático/avançado, o NCCN recomenda o uso contínuo de imatinibe até que ocorra evidência clara de progressão. Para doença progressiva, a dosagem de imatinibe pode ser aumentada para 800 mg diários para pacientes com performance status aceitável (Eastern Cooperative Oncology Group [ECOG] pontuação 0-2), ou a terapia pode ser alterada para sunitinibe (Sutent), um TKI mais recente que demonstrou fornecer benefício clínico significativo em GIST avançado resistente a imatinibe. Os GISTs com mutações secundárias nos exões 13 e 14 são sensíveis ao sunitinib.
A FDA aprovou o sunitinibe em 2006 para o tratamento de pacientes com GISTs cuja doença progrediu ou que são incapazes de tolerar o tratamento com imatinibe. Uma análise interina mostrou que o tratamento com sunitinibe atrasou o tempo médio de progressão tumoral de GISTs para 27 semanas, em comparação com 6 semanas para pacientes que não receberam o medicamento.
O TKI regorafenib (Stivarga) recebeu a aprovação da FDA em fevereiro de 2013 para GISTs irressecáveis localmente avançados que não respondem mais ao imatinib ou sunitinib. O estudo principal de fase III mostrou que regorafenibe mais o melhor tratamento de suporte (BSC) melhorou significativamente a sobrevida livre de progressão (PFS) em comparação com placebo mais BSC. A PFS mediana foi de 4.8 meses para regorafenibe e 0.9 meses para placebo.[61]
Em uma meta-análise de três estudos randomizados e controlados em pacientes com GIST com resistência ou intolerância ao imatinibe que receberam tratamento com sunitinibe, nilotinibe ou regorafenibe (n = 541) ou placebo/tratamento de suporte (n = 267), sobrevida livre de progressão, mas não a sobrevida global, melhorou significativamente no grupo de tratamento com TKI. Em pacientes com resistência ou intolerância tanto ao imatinibe quanto ao sunitinibe, o tratamento com nilotinibe ou regorafenibe melhorou a sobrevida livre de progressão, mas não a sobrevida geral.[62] Agentes quimioterápicos adicionais incluem sorafenibe, dasatinibe e pazopanibe.
Em janeiro de 2020, o FDA aprovou o avapritinib (Ayvakit), outro TKI que inibe o PDGFRA. O avapritinibe tem como alvo os mutantes PDGFRA e PDGFRA D842, bem como múltiplos KIT exon 11, 11/17 e 17 mutantes. É indicado para adultos com GIST irressecável ou metastático contendo mutações do exon 18 do PDGFRA, incluindo mutações do PDGFRA D842V.
A aprovação do avapritinibe para GIST mutante PDGFRA foi baseada nos ensaios clínicos NAVIGATOR e VOYAGER. Os resultados demonstraram respostas duráveis em pacientes com mutações do exon 18 PDGFRA em várias linhas de tratamento. Nestes pacientes (n=43), a taxa de resposta objetiva (ORR) foi de 84% (7% de resposta completa [CR], 77% de resposta parcial [PR]). Em pacientes com mutações PDGFRA D842V (n=38), a ORR foi de 89% (95% CI: 75%, 97%; 8% CR, 82% PR). Embora a duração mediana da resposta não tenha sido atingida, 61% dos pacientes que responderam com mutações no exon 18 tiveram uma resposta com duração de 6 meses ou mais (31% dos pacientes com uma resposta contínua foram acompanhados por menos de 6 meses).[63, 64 ]
O ripretinibe (Qinlock) foi aprovado para GIST avançado em pacientes previamente tratados em maio de 2020.
A aprovação foi baseada em um estudo internacional multicêntrico, duplo-cego e controlado por placebo, INVICTUS, que inscreveu pacientes previamente tratados (n=129) com GIST irressecável, localmente avançado ou metastático. A mediana de PFS e ORR foi de 6.3 meses e 9% no grupo ripretinibe em comparação com 1 mês e 0% no grupo placebo.[65]
Terapia adjuvante com inibidores de tirosina quinase
O uso de terapia adjuvante com TKI após a ressecção cirúrgica é guiado pelo potencial maligno estimado. O NCCN propôs diretrizes para estimar o potencial maligno de GISTs, com base no tamanho do tumor e na taxa mitótica e estratificada por origem gástrica ou não gástrica.[39] Estes estão listados nas Tabelas 4 e 5, abaixo.
Tabela 4. Potencial Maligno de GISTs Gástricos (NCCN)

Tabela 5. Potencial maligno de GISTs não gástricos (NCCN)

Cuidados Cirúrgicos
A cirurgia é a terapia definitiva para GISTs localizados.[25] Apesar do sucesso comprovado do imatinibe e de outros inibidores de tirosina quinase mais recentes, a ressecção cirúrgica continua sendo o tratamento de escolha e oferece a única chance de cura do GIST.[66, 67, 68, 69, 70] O principal princípio operatório é a ressecção do tumor com margens microscópicas negativas. A ressecção ampla do tumor (por exemplo, margem de 2 cm) não demonstrou melhorar os resultados e o consenso dos especialistas é que a adesão dogmática a uma determinada largura de margem não é necessária ou recomendada. Para pequenos GISTs, a ressecção local pode ser adequada, se for tecnicamente possível e não comprometer a ressecção completa. Tumores do intestino delgado podem exigir ressecção segmentar, e uma ressecção em cunha pode ser usada para pequenos GISTs gástricos em alguns casos.[71] Zhao et al relataram que a ressecção endoscópica de espessura total (EFR) é viável para GISTs gástricos de até 5,0 cm de tamanho; embora a taxa de ressecção R0 tenha sido significativamente menor com EFR (95.3%) do que com ressecção laparoscópica ou cirúrgica (100%), EFR envolveu significativamente menos complicações pós-operatórias, menor tempo de internação e menor custo.[72] Evite a enucleação de tumores pequenos, pois é difícil prever o potencial maligno pré-operatório de GISTs, mesmo que o tumor pareça benigno. Como a ressecção limitada é adequada para pequenos GISTs malignos, técnicas cirúrgicas minimamente invasivas podem ser adotadas em casos selecionados. Para tumores localmente invasivos, pode ser indicada a ressecção em bloco de órgãos adjacentes envolvidos, como cólon, baço ou fígado. A linfadenectomia de rotina não é indicada, pois o envolvimento de linfonodos é muito raro. A recorrência e a sobrevida não estão associadas ao tipo de ressecção (ressecção em cunha versus qualquer tipo de gastrectomia), desde que seja realizada uma ressecção completa (R0). Direcione todos os esforços para evitar a ruptura do tumor durante a operação. A ruptura do tumor está associada a um pior prognóstico devido à semeadura peritoneal. Em casos de doença disseminada, considere a ressecção paliativa, porque a sobrevida em longo prazo foi relatada em alguns casos. Considere também a ressecção em pacientes com doença recorrente que se manifesta como uma lesão solitária no fígado ou na cavidade peritoneal. Relatos publicados de ressecção hepática para metástase hepática de GISTs gástricos e outros sugerem um benefício de sobrevida em pacientes selecionados. Dada a capacidade do imatinibe de tornar ressecáveis tumores GIST inicialmente inoperáveis,[73] pode haver um papel para a cirurgia citorredutora (ressecção R0 ou R1) no cenário de doença metastática recorrente confinada ao abdômen.[74] Os pacientes deveriam ter pelo menos 6 meses de terapia com imatinibe ou outro inibidor de tirosina quinase e ter apresentado doença estável ou parcialmente responsiva durante esse período. Uma minoria significativa desses pacientes requer ressecção hepática (40%) e a maioria requer ressecção multivisceral, incluindo ressecção intestinal, peritonectomia e/ou omentectomia (60%). Mesmo após essa ressecção agressiva, as ressecções R1 (ressecções microscopicamente positivas) são a regra, as ressecções R0 são raras e cerca de 5% dos pacientes ainda apresentam doença volumosa remanescente. Até 70% dos pacientes capazes de passar por uma ressecção R0/R1 no cenário de doença estável ou parcialmente responsiva desfrutam de uma sobrevida livre de progressão até 4 anos após o início da terapia com imatinibe.[75] Como a ressecção adequada para pequenos GISTs malignos pode ser obtida por ressecção em cunha, técnicas cirúrgicas minimamente invasivas podem ser consideradas em casos selecionados, como aqueles em localizações anatômicas favoráveis (por exemplo, a grande curvatura ou a parede anterior do estômago).[39]
Cirurgia laparoscópica
A ressecção laparoscópica é cada vez mais utilizada para o tratamento de GISTs. Um estudo de Chen et al concluiu que a cirurgia laparoscópica era tecnicamente possível para GISTs de até 5 cm localizados no estômago e intestino delgado. Os benefícios da ressecção laparoscópica incluíram a retomada mais rápida de uma dieta normal, internações pós-operatórias mais curtas e menos uso de analgesia. Os resultados oncológicos de curto prazo foram os mesmos da laparoscopia e da cirurgia aberta.[76] Numerosos relatórios publicados de ressecção laparoscópica de GISTs gástricos demonstraram a viabilidade e segurança desta técnica.[77, 78, 79, 80, 81, 35] Em um estudo retrospectivo de 666 pacientes submetidos à ressecção primária para um GIST gástrico menor que 20 cm, Piessen et al relataram que o tratamento laparoscópico de GISTs gástricos foi associado a morbidade geral, cirúrgica e médica significativamente menor e sobrevida livre de recorrência (RFS) significativamente melhor em 5 anos. Além disso, a análise de subgrupo de pacientes com tumores maiores que 5 cm constatou que as abordagens laparoscópica e aberta produziram morbidade intra-hospitalar comparável e RFS de 5 anos.[36]
Cuidados pós-operatórios
Dependendo do tipo de ressecção, uma sonda nasogástrica é deixada no local no pós-operatório. Garantir que o tubo esteja funcionando continuamente e permaneça desobstruído é crucial. Os critérios para a remoção de uma sonda nasogástrica variam de acordo com o clínico.
Um cateter urinário de Foley permanece no local no período pós-operatório imediato ou durante o período de ressuscitação pré-operatória em pacientes que sofreram hemorragia grave ou outras complicações. O cateter auxilia no monitoramento do estado de hidratação e serve como um guia para a ressuscitação volêmica. Uma vez que o paciente esteja estabilizado e nenhum deslocamento importante adicional de fluido seja antecipado, o cateter pode ser removido.
banheiro pulmonar
Instrua os pacientes a tossir e respirar fundo com frequência. O espirômetro de incentivo é um adjuvante importante para isso e deve ser usado pelo paciente a cada 1-2 horas enquanto estiver acordado. A mobilização precoce do paciente auxilia na manutenção de um bom toalete pulmonar.
Monitoramento
Os sinais vitais são monitorados por protocolo. Registros de entrada e saída são mantidos. A oximetria de pulso é usada quando apropriado para medir a saturação de oxigênio.
antibióticos
A menos que tenha ocorrido perfuração intestinal ou outras complicações sépticas, geralmente é suficiente uma dose única de profilaxia antibiótica intravenosa contra infecção da ferida.
Pacientes com catástrofes abdominais, como perfuração intestinal ou infarto, requerem um curso terapêutico completo de antibióticos intravenosos que cubram todo o espectro da flora intestinal.
Controle da dor, profilaxia para trombose venosa profunda e precauções para aspiração
Um cateter peridural pode ser colocado pelo pessoal da anestesia para controle da dor pós-operatória. Como alternativa, um cronograma de anestesia controlado pelo paciente pode ser solicitado.
A profilaxia contra a trombose venosa profunda é crucial porque ela e a embolia pulmonar são fontes significativas de morbidade e mortalidade pós-operatórias. As modalidades disponíveis incluem heparina subcutânea, preparações de heparina fracionada subcutânea e meias de compressão sequencial.
A cabeceira da cama pode ser mantida elevada 30-45°, ou às vezes mais alta para pacientes idosos ou durante o sono, para ajudar a prevenir a aspiração.
Complicações
As complicações podem ser divididas em categorias pré-operatórias e pós-operatórias. Complicações pré-operatórias relacionadas ao tumor geralmente ocorrem com tumores maiores que 4 cm.
As principais complicações pré-operatórias incluem:
Hemorragia
Obstrução intestinal
Volvulus
Intussuscepção
Perfuração intestinal com peritonite
A gama de complicações pós-operatórias é semelhante à de grandes cirurgias abdominais e gastrointestinais. A lista a seguir é representativa, mas não exaustiva:
infecção da ferida
Deiscência da ferida com ou sem evisceração
Infecção do trato urinário
Atelectasia
Pneumonia
Ruptura anastomótica
Estenose anastomótica
Ulceração marginal
Formação de abscesso intra-abdominal
colangite
Esvaziamento gástrico retardado ou gastroparesia
Fístula interna ou enterocutânea
Obstrução do intestino delgado
síndrome de dumping
Gastrite por refluxo alcalino
Arritmia cardíaca
Infarto do miocárdio
Trombose venosa profunda
Embolia pulmonar
Consultas
O manejo dos GISTs requer a participação de uma equipe multidisciplinar. A equipe deve incluir um cirurgião, gastroenterologista e oncologista.
Dieta
No pós-operatório, os pacientes não recebem nada por via oral por períodos variados, dependendo da preferência do cirurgião. Após a remoção da sonda nasogástrica, os pacientes podem iniciar uma dieta líquida e avançar para uma dieta completa conforme tolerado. O aconselhamento dietético pós-gastrectomia por um nutricionista registrado é útil em pacientes submetidos a gastrectomias subtotais ou totais.
Dependendo do estado nutricional pré-operatório do paciente, pode ser indicado um período de suporte nutricional especializado. Isso pode variar de alimentação por sonda enteral a hiperalimentação periférica e nutrição parenteral total. Suplementação multivitamínica e de ferro pode ser indicada.
Monitoramento de Longo Prazo
O acompanhamento após operações curativas é importante porque certos pacientes com doença recorrente podem se beneficiar de uma segunda intervenção cirúrgica e da terapia sistêmica com inibidores de tirosina quinase para doença irressecável e/ou metastática. O acompanhamento inclui exame físico e tomografia computadorizada (TC) e, possivelmente, gastroscopias periódicas também.
Para acompanhamento de GISTs gástricos < 2 cm que foram completamente ressecados, as recomendações da National Comprehensive Cancer Network (NCCN) variam de acordo com a presença ou ausência de características de alto risco (por exemplo, borda irregular, espaços císticos, ulceração, focos ecogênicos, heterogeneidade ). Para GISTs com características de alto risco, o NCCN recomenda considerar TC abdominal/pélvica com contraste a cada 3-6 meses por 5 anos, depois anualmente. Para aqueles sem características de alto risco, a vigilância endoscópica em intervalos de 6 a 12 meses pode ser considerada.[39]
Para acompanhamento de pacientes com doença residual macroscópica persistente ou metastática, o NCCN recomenda acompanhamento com história e exame físico e TC abdominal/pélvica a cada 3-6 meses. Para pacientes com GISTs completamente ressecados, o NCCN recomenda história, exame físico e TC abdominal/pélvica a cada 3-6 meses por 5 anos, depois anualmente.[39]
Diretrizes
Resumo das Diretrizes
Classificação de Tumores da OMS
Em 2013, a Organização Mundial da Saúde divulgou uma atualização de seu sistema de classificação de 2002 para tumores de tecidos moles e ossos. A atualização incorporou dados citogenéticos e moleculares mais detalhados nas classificações. Tumores estromais gastrointestinais (GISTs) foram adicionados na atualização, com três subtipos[82]:
Benigno
Potencial maligno incerto
Maligno
Sistemas de classificação de tumores
O sistema do Grupo de Sarcoma da Federação Francesa de Centros de Câncer (FNCLCC) [83] e o sistema do Instituto Nacional do Câncer são mais comumente usados para classificar os sarcomas de tecidos moles.[84] Ambos são sistemas de três graus. O FNCLCCC é baseado na diferenciação tumoral, necrose tumoral e atividade mitótica, enquanto o sistema NCI baseia a avaliação na histologia, localização e necrose tumoral. Em estudos de comparação, o FNCLCCC mostrou uma capacidade ligeiramente melhor de prever o desenvolvimento de metástases e a mortalidade.
O American Joint Cancer Committee/Union for International Cancer Control (AJCC/UICC) classifica GISTs separadamente de outros sarcomas, usando um sistema de dois graus baseado na taxa mitótica, como segue[39]:
Baixo: ≤5 mitoses por 5 mm 2 , ou por 50 campos de alta potência (HPF)
Alta: > 5 mitoses por 5 mm 2 , ou por 50 HPF
Estadiamento do Tumor
Para o estadiamento de GISTs, as diretrizes da NCCN e da European Society for Medical Oncology (ESMO) seguem a classificação tumor-nodo-metástase (TNM) da AJCC/UICC. Os agrupamentos de estágio anatômico/prognóstico para GIST são detalhados na Tabela 4, abaixo.[51]
Tabela 4. Estadiamento dos Tumores Estromais Gastrointestinais Gástricos


Diagnóstico
As diretrizes da NCCN para GISTs recomendam avaliação e manejo, antes do início da terapia, por uma equipe multidisciplinar com conhecimento e experiência em sarcoma. A tomografia computadorizada abdominal/pélvica com contraste, com ou sem ressonância magnética, também é indicada e a imagem do tórax deve ser considerada. GISTs gástricos muito pequenos (< 2 cm) podem ser avaliados com aspiração por agulha fina guiada por ultrassonografia endoscópica; para GISTs de 2 cm ou mais, a endoscopia com ou sem ultrassonografia também pode ser indicada em pacientes selecionados.[39]
O teste genético para KIT e PDGFRA é uma forte recomendação quando a terapia médica está sendo considerada. A identificação de certas mutações específicas de KIT e PDGFRA ajuda a prever a capacidade de resposta ao imatinibe e o possível benefício de uma dose mais alta de imatinibe.
Em pacientes com GISTs sem mutações KIT ou PDGFRA, imuno-histoquímica (IHC) para deficiência de SDHB, para tumores gástricos e teste de mutação da succinato desidrogenase (SDH) para tumores com deficiência de SDHB é indicada. Mutações de perda de função germinativa nas subunidades do gene SDH SDHB, SDHC e SDHD foram identificadas em indivíduos com GISTs associados à síndrome de Carney-Stratakis, uma síndrome familiar autossômica dominante caracterizada por uma predisposição a GISTs e paragangliomas. Além disso, o teste de sequenciamento de próxima geração (NGS) para mutações condutoras alternativas (por exemplo, BRAF, NF1, NTRK e fusões FGFR) deve ser realizado, pois pode identificar tumores que poderiam responder à terapia direcionada.[39]
Tratamento
As recomendações de tratamento da NCCN para doença ressecável localizada incluem o seguinte[39] :
A ressecção cirúrgica é recomendada para tumores gástricos < 2 cm sem características de alto risco (por exemplo, borda irregular, espaços císticos, ulceração, focos ecogênicos, heterogeneidade) e para GISTs conhecidos ou suspeitos ressecáveis com morbidade mínima.
Considere vigilância endoscópica ou radiográfica periódica para GISTs gástricos < 2 cm sem características de alto risco.
Para GISTs ressecáveis, mas com morbidade significativa, considere imatinibe neoadjuvante ou avapritinibe para GISTs com mutações no exon 18 do PDGFRA que produzem insensibilidade ao imatinibe (por exemplo, a mutação D842V). Prossiga com cirurgia, se possível.
Após ressecção completa, tratar com imatinibe adjuvante em pacientes com risco intermediário ou alto de recorrência; continuar o imatinibe em pacientes que o receberam no pré-operatório.
Acompanhe com história e TC física e abdominal/pélvica a cada 3-6 meses por 5 anos, depois anualmente.
As diretrizes da ESMO recomendam que pacientes com pequenos nódulos esofagogástricos ou duodenais < 2 cm sejam submetidos a avaliação ultrassonográfica endoscópica e, a seguir, acompanhamento anual, reservando a excisão para pacientes cujo tumor aumente de tamanho ou se torne sintomático. No entanto, para nódulos retais pequenos, as diretrizes da ESMO recomendam biópsia/excisão após avaliação ultrassonográfica, independentemente do tamanho do tumor. Além disso, todos os nódulos de 2 cm ou mais requerem biópsia. As diretrizes da ESMO desencorajam uma abordagem laparoscópica para ressecção de grandes tumores.[25]
O NCCN recomenda a terapia com inibidores de tirosina quinase (TKI) para doenças irressecáveis, recorrentes ou metastáticas, como segue (todas as categorias 1)[39]:
Imatinibe
Após avaliação do efeito terapêutico, a ressecção pode ser considerada ou o imatinibe pode ser continuado se a ressecção não for viável
Sunitinibe para pacientes com GIST resistente a imatinibe
Regorafenibe para pacientes com progressão da doença em uso de imatinibe e sunitinibe
Ripretinibe para pacientes com progressão da doença em uso de imatinibe, sunitinibe e regorafenibe
A terapia com TKI deve ser continuada enquanto os pacientes apresentarem benefício clínico (resposta ou doença estável)
A continuação da terapia com TKI por toda a vida para aliviar os sintomas é um componente essencial do melhor tratamento de suporte
Medicamento
Resumo de Medicação
Os objetivos da farmacoterapia em pacientes com tumores estromais gastrointestinais (GISTs) são induzir a remissão, reduzir a morbidade e prevenir complicações. Os inibidores de tirosina quinase (TKIs) imatinibe ou avapritinibe são indicados para GISTs irressecáveis e GISTs malignos metastáticos. Evidências de marcadores genéticos para KIT e PDGFRA são essenciais para determinar quais opções terapêuticas são ideais.
Antineoplásicos, Inibidor de Tirosina Quinase
Resumo da aula
Agentes com forte atividade de inibição da tirosina-quinase da anormalidade bcr-abl em todas as fases do ciclo celular das células tumorais gástricas.
Mesilato de imatinibe (Gleevec)
Projetado especificamente para inibir a atividade da tirosina-quinase da bcr-abl quinase em tumores do estroma GI. Esses tumores são caracterizados pela expressão do produto do proto-oncogene c-kit e muitas vezes abrigam mutações KIT de ganho de função, levando à ativação da quinase independente do ligante. Gleevec inibe ABL, KIT e PDGFR tirosina quinase.
Malato de sunitinibe (SU-11248, Sutent)
Inibidor multiquinase que tem como alvo vários inibidores de tirosina-quinase implicados no crescimento tumoral, angiogênese patológica e progressão metastática. Inibe os receptores do fator de crescimento derivado de plaquetas (ou seja, PDGFR-alfa, PDGFR-beta), receptores do fator de crescimento endotelial vascular (ou seja, VEGFR1, VEGFR2, VEGFR3), receptor do fator de células-tronco (KIT), tirosina quinase tipo Fms-3 ( FLT3), receptor do fator estimulador de colônia tipo 1 (CSF-1R) e receptor do fator neurotrófico derivado da linha celular glial (RET).
Indicado para pessoas com GISTs cuja doença progrediu ou que são incapazes de tolerar o tratamento com imatinibe (Gleevec). Atrasa o tempo médio de progressão do tumor.
Regorafenibe (Stivarga)
Regorafenib é um inibidor da tirosina quinase. É indicado para tumores estromais gastrointestinais localmente avançados e irressecáveis que não respondem mais a outros tratamentos (por exemplo, imatinibe, sunitinibe).
Avapritinibe (Ayvakit)
O avapritinibe é um inibidor da tirosina quinase que tem como alvo os mutantes PDGFRA e PDGFRA D842, bem como múltiplos KIT exon 11, 11/17 e 17 mutantes. Isso resulta na inibição das vias de transdução de sinal mediadas por PDGFRa e c-Kit e na inibição da proliferação em células tumorais que expressam esses mutantes de PDGFRa e c-Kit. É indicado para adultos com GIST irressecável ou metastático com mutações no exon 18 do receptor alfa do fator de crescimento derivado de plaquetas (PDGFRA), incluindo mutações PDGFRA D842V.
Ripretinibe (Qinlock)
O ripretinibe é um inibidor de amplo espectro ou receptor tirosina quinase (KIT) do receptor proto-oncogênico e receptor A do fator de crescimento derivado de plaquetas (PDGFRA), incluindo mutações de tipo selvagem, primárias e secundárias. É indicado para GISTs avançados em adultos que receberam tratamento prévio com 3 ou mais inibidores da quinase, incluindo imatinibe.
Referências
Conselho Editorial de Tratamento de Adultos do PDQ. Tratamento de Tumores Estromais Gastrointestinais (Adulto) (PDQ®): Versão para Profissionais de Saúde. 16 de setembro de 2020. [Link QxMD MEDLINE]. [Texto completo].
Ghanem N, Altehoefer C, Furtwängler A, Winterer J, Schäfer O, Springer O, et al. Tomografia computadorizada em tumores estromais gastrointestinais. Eur Radiol. 13 de julho de 2003 (7):1669-78. [Link QxMD MEDLINE].
Zhou HY, Zhang XM, Zeng NL, Jian SH, Tang W. Uso de ressonância magnética convencional e imagem ponderada por difusão para avaliar o grau de risco de tumores estromais gastrointestinais. J Magn Resson Imaging. 36 de dezembro de 2012 (6):1395-401. [Link QxMD MEDLINE].
Chak A, Canto MI, Rosch T, et al. Diferenciação endossonográfica de tumores de células estromais benignos e malignos. Gastrointestinal Endosc. 1997 junho 45(6):468-73. [Link QxMD MEDLINE].
DeMatteo RP, Ballman KV, Antonescu CR, et al. Mesilato de imatinibe adjuvante após ressecção de tumor estromal gastrointestinal primário: um estudo randomizado, duplo-cego, controlado por placebo. Lanceta. 28 de março de 2009. 373:1097-1104. [Link QxMD MEDLINE].
Kindblom LG, Remotti HE, Aldenborg F, Meis-Kindblom JM. Tumor de células marcapasso gastrointestinais (GIPACT): tumores estromais gastrointestinais apresentam características fenotípicas das células intersticiais de Cajal. Am J Pathol. 1998 Maio. 152 (5):1259-69. [Link QxMD MEDLINE]. [Texto completo].
Hirota S, Isozaki K, Moriyama Y, Hashimoto K, Nishida T, Ishiguro S, et al. Mutações de ganho de função de c-kit em tumores estromais gastrointestinais humanos. Ciência. 23 de janeiro de 1998. 279 (5350):577-80. [Link QxMD MEDLINE].
Kang HJ, Koh KH, Yang E, You KT, Kim HJ, Paik YK. Proteínas diferencialmente expressas em tumores estromais gastrointestinais com mutações KIT e PDGFRA. Proteômica. 6(4):1151-7 de fevereiro de 2006. [Link QxMD MEDLINE].
Medeiros F, Corless CL, Duensing A, Hornick JL, Oliveira AM, Heinrich MC. Tumores estromais gastrointestinais KIT-negativos: prova de conceito e implicações terapêuticas. Am J Surg Pathol. 2004 julho 28(7):889-94. [Link QxMD MEDLINE].
Miettinen M, Sobin LH, Sarlomo-Rikala M. Espectro imuno-histoquímico de GISTs em diferentes locais e seu diagnóstico diferencial com referência a CD117 (KIT). Mod Pathol. 2000 Out. 13(10):1134-42. [Link QxMD MEDLINE].
Van Oosterom AT, Judson I, Verweij J, et al. STI 571, uma droga ativa em tumores gastrointestinais metastáticos (GIST), um estudo de fase I da EORTC. Apresentação Plenária. Sociedade Americana de Oncologia Clínica, 37ª Reunião Anual. 2001.
Bauer S, Lang H, Schütte J, Hartmann JT. Remissão completa com imatinibe em tumores estromais gastrointestinais metastáticos. J Clin Oncol. 20 de setembro de 2005. 23(27):6800-1; resposta do autor 6801-2. [Link QxMD MEDLINE].
Benjamin RS, Blanke CD, Blay JY, Bonvalot S, Eisenberg B. Manejo de tumores estromais gastrointestinais na era do imatinibe: estudos de casos selecionados. Oncologista. 11(1):9-20 de janeiro de 2006. [Link QxMD MEDLINE].
Koh JS, Trent J, Chen L, et al. Tumores estromais gastrointestinais: visão geral das características patológicas, biologia molecular e terapia com mesilato de imatinibe. Histol Histopatol. 19 de abril de 2004(2):565-74. [Link QxMD MEDLINE].
Maki RG. Tumores estromais gastrointestinais respondem à terapia direcionada à tirosina quinase. Curr Treat Options Gastroenterol. 2004 Fevereiro 7(1):13-17. [Link QxMD MEDLINE].
Melichar B, Voboril Z, Nozicka J, Ryska A, Urminská H, Vanecek T. Resposta patológica completa em tumor estromal gastrointestinal avançado após terapia com imatinibe. Interna Med. 2005 Nov. 44(11):1163-8. [Link QxMD MEDLINE].
Miettinen M, Lasota J. Tumores estromais gastrointestinais - definição, características clínicas, histológicas, imuno-histoquímicas e genéticas moleculares e diagnóstico diferencial. Arco de Virchows. 2001 janeiro 438(1):1-12. [Link QxMD MEDLINE].
Miettinen M, El-Rifai W, HL Sobin L, Lasota J. Avaliação de malignidade e prognóstico de tumores estromais gastrointestinais: uma revisão. Hum Pathol. Maio de 2002. 33 (5):478-83. [Link QxMD MEDLINE].
Fukasawa T, Chong JM, Sakurai S, Koshiishi N, Ikeno R, Tanaka A, et al. Perda alélica de 14q e 22q, mutação NF2 e instabilidade genética ocorrem independentemente da mutação c-kit no tumor estromal gastrointestinal. Jpn J Câncer Res. 91 de dezembro de 2000 (12):1241-9. [Link QxMD MEDLINE].
Rege TA, Wagner AJ, Corless CL, Heinrich MC, Hornick JL. Tumores estromais gastrointestinais "do tipo pediátrico" em adultos: histologia distinta prediz genótipo e comportamento clínico. Am J Surg Pathol. 35(4):495-504 de abril de 2011. [Link QxMD MEDLINE].
Hirota S, Isozaki K. Patologia dos tumores estromais gastrointestinais. Patol Int. 2006 janeiro 56(1):1-9. [Link QxMD MEDLINE].
Rubin BP, Singer S, Tsao C, Duensing A, Lux ML, Ruiz R, et al. A ativação do KIT é uma característica onipresente dos tumores estromais gastrointestinais. Res. de Câncer 15 de novembro de 2001. 61 (22):8118-21. [Link QxMD MEDLINE].
Agaimy A, Terracciano LM, Dirnhofer S, Tornillo L, Foerster A, Hartmann A, et al. As mutações V600E BRAF são eventos moleculares precoces alternativos em um subconjunto de tumores estromais gastrointestinais de tipo selvagem KIT/PDGFRA. J Clin Pathol. 2009 julho 62 (7):613-6. [Link QxMD MEDLINE].
Fukasawa T, Chong JM, Sakurai S, Koshiishi N, Ikeno R, Tanaka A, et al. Perda alélica de 14q e 22q, mutação NF2 e instabilidade genética ocorrem independentemente da mutação c-kit no tumor estromal gastrointestinal. Jpn J Câncer Res. 91 de dezembro de 2000 (12):1241-9. [Link QxMD MEDLINE].
[Diretriz] Casli PG, e outros; Comitê de Diretrizes da ESMO, EURACAN e GENTURIS. Tumores estromais gastrointestinais: Diretrizes de Prática Clínica ESMO-EURACAN-GENTURIS para diagnóstico, tratamento e acompanhamento. Ana Oncol. 33 de janeiro de 2022 (1):20-33. [Link QxMD MEDLINE]. [Texto completo].
Carney JA. Sarcoma estromal gástrico, condroma pulmonar e paraganglioma extra-adrenal (Tríade de Carney): história natural, componente adrenocortical e possível ocorrência familiar. Mayo Clin Proc. 1999 junho 74 (6):543-52. [Link QxMD MEDLINE].
Ma GL, Murphy JD, Martinez ME, Sicklick JK. Epidemiologia dos tumores estromais gastrointestinais na era dos códigos histológicos: resultados de um estudo de base populacional. Biomarcadores epidemiológicos do câncer Prev. 2015 24 de janeiro (1):298-302. [Link QxMD MEDLINE]. [Texto completo].
Tryggvason G, Gíslason HG, Magnússon MK, Jónasson JG. Tumores estromais gastrointestinais na Islândia, 1990-2003: o estudo islandês GIST, uma incidência populacional e estudo de estratificação de risco patológico. Int J Câncer. 1 de novembro de 2005. 117 (2):289-93. [Link QxMD MEDLINE].
Goettsch WG, Bos SD, Breekveldt-Postma N, Casparie M, Herings RM, Hogendoorn PC. A incidência de tumores estromais gastrointestinais é subestimada: resultados de um estudo nacional. Eur J Câncer. 2005, 41 de dezembro (18):2868-72. [Link QxMD MEDLINE].
Rubió J, Marcos-Gragera R, Ortiz MR, Miró J, Vilardell L, Gironès J, et al. Incidência populacional e sobrevida de tumores estromais gastrointestinais (GIST) em Girona, Espanha. Eur J Câncer. 2007 janeiro 43 (1):144-8. [Link QxMD MEDLINE].
Nilsson B, Bümming P, Meis-Kindblom JM, Odén A, Dortok A, Gustavsson B, et al. Tumores estromais gastrointestinais: incidência, prevalência, curso clínico e prognóstico na era do mesilato de preimatinibe - um estudo de base populacional no oeste da Suécia. Câncer. 15 de fevereiro de 2005. 103 (4):821-9. [Link QxMD MEDLINE].
Aparicio T, Boige V, Sabourin JC, Crenn P, Ducreux M, Le Cesne A. Fatores prognósticos após cirurgia de tumores estromais gastrointestinais ressecáveis primários. Eur J Surg Oncol. 30(10) de dezembro de 2004:1098-103. [Link QxMD MEDLINE].
Koga H, Ochiai A, Nakanishi Y, et al. Reavaliação dos fatores prognósticos no leiomiossarcoma gástrico. Am J Gastroenterol. 1995 agosto 90(8):1307-12. [Link QxMD MEDLINE].
Ng EH, Pollock RE, Romsdahl MM. Implicações prognósticas de padrões de falha para leiomiossarcomas gastrointestinais. Câncer. 1992, 15 de março. 69(6):1334-41. [Link QxMD MEDLINE].
Rosen MJ, Heniford BT. Cirurgia gástrica endoluminal: a era moderna da cirurgia minimamente invasiva. Surg Clin North Am. 2005 Out. 85(5):989-1007, vii. [Link QxMD MEDLINE].
Piessen G, Lefèvre JH, Cabau M, et al. Cirurgia Laparoscópica Versus Aberta para Tumores Estromais Gastrointestinais Gástricos: Qual é o Impacto no Resultado Pós-operatório e Resultados Oncológicos?. Ana Cirurg. 2015 novembro 262 (5):831-40. [Link QxMD MEDLINE].
Fletcher CD, Berman JJ, Corless C, Gorstein F, Lasota J, Longley BJ, et al. Diagnóstico de tumores estromais gastrointestinais: uma abordagem consensual. Hum Pathol. Maio de 2002. 33 (5):459-65. [Link QxMD MEDLINE].
Gold JS, Gönen M, Gutiérrez A, Broto JM, García-del-Muro X, Smyrk TC, et al. Desenvolvimento e validação de um nomograma prognóstico para sobrevida livre de recorrência após ressecção cirúrgica completa de tumor estromal gastrointestinal primário localizado: uma análise retrospectiva. Lancet Oncol. 10 de novembro de 2009 (11):1045-52. [Link QxMD MEDLINE].
[Diretriz] National Comprehensive Cancer Network. Diretrizes de Prática Clínica da NCCN em Oncologia: Tumores Estromais Gastrointestinais (GISTs). NCCN.org. Disponível em https://www.nccn.org/professionals/physician_gls/pdf/gist.pdf. Versão 1.2022 — 21 de janeiro de 2022; Acesso: 23 de maio de 2022.
Sineshaw HM, Jemal A, Lin CC, McGinnis LS, Ward EM. Padrões Contemporâneos e Resultado de Sobrevida da Terapia Sistêmica Adjuvante para Tumores Estromais Gastrointestinais Localizados. Am J Clin Oncol. 16 de janeiro de 2015. [Link QxMD MEDLINE].
Graadt van Roggen JF, van Velthuysen ML, Hogendoorn PC. O diagnóstico diferencial histopatológico de tumores estromais gastrointestinais. J Clin Pathol. 2001 fevereiro 54(2):96-102. [Link QxMD MEDLINE].
Rei DM. Radiologia dos tumores estromais gastrointestinais (GIST). Imagem do Câncer. 2005. 5:150-6. [Link QxMD MEDLINE].
Yamashita F, Sasatomi E, Kiyama M, Fukumori K, Yano Y, Kato O, et al. Observação radiográfica de um caso de tumor estromal gastrointestinal no estômago. Kurume Med J. 2001. 48 (3):233-6. [Link QxMD MEDLINE].
Stroobants S, Goeminne J, Seegers M, Dimitrijevic S, Dupont P, Nuyts J, et al. Tomografia por emissão de pósitrons 18FDG para predição precoce de resposta em sarcoma avançado de partes moles tratado com mesilato de imatinibe (Glivec). Eur J Câncer. 39 de setembro de 2003 (14):2012-20. [Link QxMD MEDLINE].
Palazzo L, Landi B, Cellier C, et al. Características endossonográficas preditivas de tumores de células estromais gastrointestinais benignos e malignos. Intestino. 2000 Jan. 46(1):88-92. [Link QxMD MEDLINE].
Fields S, Libson E. Biópsia com agulha grossa guiada por TC de lesões da parede gastrointestinal. J Comput Assist Tomogr. 2000 Mar-Abr. 24(2):224-8. [Link QxMD MEDLINE].
Kikuchi H, Yamashita K, Kawabata T, Yamamoto M, Hiramatsu Y, Kondo K. Características imuno-histoquímicas e genéticas de tumores estromais gastrointestinais gástricos e metastáticos do fígado: análises sequenciais. Câncer Ciência. 2006 fevereiro 97(2):127-32. [Link QxMD MEDLINE].
Montgomery E, Abraham SC, Fisher C, et al. Perda de CD44 em tumores estromais gástricos como marcador prognóstico. Am J Surg Pathol. 28(2):168-77 de fevereiro de 2004. [Link QxMD MEDLINE].
Franquemont DW. Diferenciação e avaliação de risco de tumores estromais gastrointestinais. Am J Clin Pathol. 1995 janeiro 103(1):41-7. [Link QxMD MEDLINE].
Tzen CY, Mau BL. Análise de tumores estromais gastrointestinais CD117-negativos. World J Gastroenterol. 2005, 21 de fevereiro. 11(7):1052-5. [Link QxMD MEDLINE].
Sarcoma de Partes Moles. Amin MB, Edge S, Greene F. AJCC Cancer Staging Manual. 8ª Ed. Cham: Suíça: Springer International Publishing; 2017. 489-548.
Joensuu H, Roberts PJ, Sarlomo-Rikala M, et al. Efeito do inibidor de tirosina quinase STI571 em um paciente com tumor estromal gastrointestinal metastático. N Engl J Med. 5 de abril de 2001. 344(14):1052-6. [Link QxMD MEDLINE].
Tuveson DA, Willis NA, Jacks T, et al. Inativação do STI571 da oncoproteína c-KIT do tumor estromal gastrointestinal: implicações biológicas e clínicas. Oncogene. 16 de agosto de 2001. 20(36):5054-8. [Link QxMD MEDLINE].
Pisters PW, Patel SR. Tumores estromais gastrointestinais: manejo atual. J Surg Oncol. 1 de outubro de 2010. 102 (5):530-8. [Link QxMD MEDLINE].
Demetri GD, van Oosterom AT, Garrett CR, Blackstein ME, Shah MH, Verweij J, et al. Eficácia e segurança do sunitinibe em pacientes com tumor estromal gastrointestinal avançado após falha do imatinibe: um estudo controlado randomizado. Lanceta. 14 de outubro de 2006. 368 (9544):1329-38. [Link QxMD MEDLINE].
Senchak J, Ahr K, von Mehren M. Tumores estromais gastrointestinais: qual é a melhor sequência de TKIs?. Curr Treat Options Oncol. 2022 Maio. 23 (5):749-761. [Link QxMD MEDLINE].
Nannini M, Rizzo A, Indio V, Schipani A, Astolfi A, Pantaleo MA. Terapia direcionada em GIST deficiente em SDH. Ther Adv Med Oncol. 2021. 13:17588359211023278. [Link QxMD MEDLINE]. [Texto completo].
Neppala P, Banerjee S, Fanta PT, Yerba M, Porras KA, Burgoyne AM, et al. Manejo atual de tumores estromais gastrointestinais deficientes em succinato desidrogenase. Cancer Metastasis Rev. 2019 Set. 38 (3):525-535. [Link QxMD MEDLINE].
Verweij J, Casali PG, Zalcberg J, LeCesne A, Reichardt P, Blay JY. Sobrevida livre de progressão em tumores estromais gastrointestinais com alta dose de imatinibe: estudo randomizado. Lanceta. 25 de setembro de 2004 a 1º de outubro. 364(9440):1127-34. [Link QxMD MEDLINE].
Joensuu H, Eriksson M, Hatrmann I, et al. Doze versus 36 meses de imatinibe adjuvante (IM) como tratamento de GIST operável com alto risco de recorrência: resultados finais de um estudo randomizado (SSGXVIII/AIO). Reunião Anual da Sociedade Americana de Oncologia Clínica (ASCO) de 2011. Resumo LBA1. Apresentado em 5 de junho de 2011.
Demetri GD, Reichardt P, Kang YK, Blay JY, Rutkowski P, Gelderblom H, et al. Eficácia e segurança de regorafenibe para tumores estromais gastrointestinais avançados após falha de imatinibe e sunitinibe (GRID): um estudo de fase 3 internacional, multicêntrico, randomizado, controlado por placebo. Lanceta. 26 de janeiro de 2013. 381(9863):295-302. [Link QxMD MEDLINE].
Wu L, Zhang Z, Yao H, Liu K, Wen Y, Xiong L. Eficácia clínica de inibidores de tirosina quinase de segunda geração em tumores estromais gastrointestinais resistentes a imatinibe: uma meta-análise de ensaios clínicos recentes. Drug Des Devel Ther. 2014. 8:2061-7. [Link QxMD MEDLINE]. [Texto completo].
Heinrich M, von Mehren M, Jones RL, Bauer S, Yoon-Koo K, Schöfski P, et al. O avapritinibe é altamente ativo e bem tolerado em pacientes com GIST avançado causado por uma variedade diversificada de mutações oncogênicas em KIT e PDGFRA. Apresentado na Reunião Anual da Sociedade de Oncologia do Tecido Conjuntivo 2018. Roma, IT. 15 de novembro de 2018. [Texto completo].
Bauer S, George S, Yoon-Koo K, Tap WD, Zhou T, Picazio N, et al. Um estudo aberto, randomizado, de fase 3 de avapritinibe versus regorafenibe em pacientes com tumores estromais gastrointestinais localmente avançados metastáticos ou irressecáveis. Apresentado no congresso anual da European Society for Medical Oncology (ESMO). Munique, Alemanha. 19 a 23 de outubro de 2018. [Texto completo].
Qinlock (ripretinibe) [bula]. Waltham, MA: Deciphera Pharmaceuticals, LLC. Maio de 2020. Disponível em [Full Text].
Boni L, Benevento A, Dionigi G, Rovera F, Dionigi R. Ressecção cirúrgica de tumores estromais gastrointestinais (GIST): experiência em 25 pacientes. World J Surg Oncol. 2005. 3:78. [Link QxMD MEDLINE].
Bucher P, Egger JF, Gervaz P, Ris F, Weintraub D, Villiger P. Uma auditoria de tratamento cirúrgico de tumores estromais gastrointestinais (GIST). Eur J Surg Oncol. 32(3):310-4 de abril de 2006. [Link QxMD MEDLINE].
Knoop M, St Friedrichs K, Dierschke J. Tratamento cirúrgico de tumores estromais gastrointestinais do estômago. Langenbecks Arch Surg. 2000 abr. 385(3):194-8. [Link QxMD MEDLINE].
Kosmadakis N, Visvardis EE, Kartsaklis P, Tsimara M, Chatziantoniou A, Panopoulos I. O papel da cirurgia no tratamento de tumores estromais gastrointestinais (GISTs) na era da eficácia do mesilato de imatinibe. Cirurg Oncol. 14(2):75-84 de agosto de 2005. [Link QxMD MEDLINE].
Guo Y, Liu J, Wang F, Wang Q, Zheng G, Liu S, et al. O Papel da Ressecção Cirúrgica Após Tratamento com Inibidores de Tirosina Quinase em Pacientes com Tumores Estromais Gastrointestinais Avançados: Uma Revisão Sistemática e Metanálise. Câncer J. 2019. 10 (23):5785-5792. [Link QxMD MEDLINE]. [Texto completo].
Katai H, Sasako M, Sano T. Ressecção em cunha do estômago para leiomiossarcoma gástrico. Br J Surg. 1997 abr. 84(4):560-1. [Link QxMD MEDLINE].
Zhao Y, Pang T, Zhang B, Wang L, Lv Y, Ling T, et al. Comparação Retrospectiva de Ressecção Endoscópica de Espessura Total Versus Laparoscópica ou Cirúrgica de Pequenos (≤ 5 cm) Tumores Estromais Gastrointestinais Gástricos. J Gastrointestinal Surg. 10 de dezembro de 2019. [Link QxMD MEDLINE].
Eisenberg BL, Judson I. Cirurgia e imatinibe no manejo do GIST: abordagens emergentes para terapia adjuvante e neoadjuvante. Ann Surg Oncol. Maio de 2004. 11(5):465-75. [Link QxMD MEDLINE].
Rutkowski P, Nonecki Z, Nyckowski P, Dziewirski W, Grzesiakowska U, Nasierowska-Guttmejer A. Tratamento cirúrgico de pacientes com tumores estromais gastrointestinais (GIST) inicialmente inoperáveis e/ou metastáticos durante a terapia com mesilato de imatinibe. J Surg Oncol. 15 de março de 2006. 93(4):304-11. [Link QxMD MEDLINE].
Chen H, Pruitt A, Nicol TL, et al. A ressecção hepática completa de metástases de leiomiossarcoma prolonga a sobrevida. J Gastrointestinal Surg. 1998 Mar-Abr. 2(2):151-5. [Link QxMD MEDLINE].
Chen YH, Liu KH, Yeh CN, Hsu JT, Liu YY, Tsai CY e outros. Ressecção laparoscópica de tumores estromais gastrointestinais: resultados oncológicos seguros, eficientes e comparáveis. J Laparoendosc Adv Surg Tech A. 2012 Out. 22 (8):758-63. [Link QxMD MEDLINE].
Aogi K, Hirai T, Mukaida H, et al. Ressecção videolaparoscópica de tumores gástricos submucosos. Cirurg hoje. 1999. 29(2):102-6. [Link QxMD MEDLINE].
Bedard EL, Mamazza J, Schlachta CM, Poulin EC. Ressecção laparoscópica de tumores estromais gastrointestinais: nem todos os tumores são criados iguais. Cirurg Endosc. 2006 Mar. 20(3):500-3. [Link QxMD MEDLINE].
Hindmarsh A, Koo B, Lewis MP, Rhodes M. Ressecção laparoscópica de tumores estromais gastrointestinais gástricos. Cirurg Endosc. 19(8):1109-12 de agosto de 2005. [Link QxMD MEDLINE].
Kitano S, Shiraishi N. Cirurgia minimamente invasiva para tumores gástricos. Surg Clin North Am. 2005 fevereiro 85(1):151-64, xi. [Link QxMD MEDLINE].
Nguyen SQ, Divino CM, Wang JL, Dikman SH. Tratamento laparoscópico de tumores estromais gastrointestinais. Cirurg Endosc. Maio de 2006. 20(5):713-6. [Link QxMD MEDLINE].
Fletcher CDM, Bridge JA, Hogendoorn P, Mertens F. Classificação da Organização Mundial da Saúde para Tumores de Tecidos Moles e Ossos. 4ª Ed. Lyon, França: IARC; 2013.
Trojani M, Contesso G, Coindre JM, Rouesse J, Bui NB, de Mascarel A, et al. sarcomas de partes moles de adultos; estudo de variáveis prognósticas patológicas e definição de um sistema de graduação histopatológica. Int J Câncer. 1984 15 de janeiro. 33 (1):37-42. [Link QxMD MEDLINE].
Costa J, Wesley RA, Glatstein E, Rosenberg SA. Classificação dos sarcomas de partes moles. Resultados de uma correlação clínico-histopatológica em uma série de 163 casos. Câncer. 1 de fevereiro de 1984. 53 (3): 530-41. [Link QxMD MEDLINE].
Atualizado: 24 de maio de 2022 Autor: Michael A Choti, MD, MBA, FACS; Editor Chefe: N Joseph Espat, MD, MS, FACS Autor
Michael A Choti, MD, MBA, FACS Chief of Surgery, Banner MD Anderson Cancer Center Michael A Choti, MD, MBA, FACS é membro das seguintes sociedades médicas: American Association for the Study of Liver Diseases , American College of Surgeons , Associação Hepato-Pancreato-Biliar das Américas , Sociedade Americana de Oncologia Clínica , Associação Cirúrgica Americana , Associação de Cirurgia Acadêmica , Associação Hepato-Pancreato-Biliar Internacional , Sociedade de Cirurgia do Trato Alimentar , Sociedade de Oncologia Cirúrgica , Sociedade de Cirurgiões Universitários Coautor(es)
Rajesh Ramanathan, MD Cirúrgico Oncologista, Banner MD Anderson Cancer Center, Arizona Conselho Editorial Especializado
Francisco Talavera, PharmD, PhD Professor Assistente Adjunto, Faculdade de Farmácia do Centro Médico da Universidade de Nebraska; Editor-chefe, Medscape Drug Reference
Editor chefe
N Joseph Espat, MD, MS, FACS Harold J Wanebo Professor de Cirurgia, Reitor Assistente de Assuntos Clínicos, Escola de Medicina da Universidade de Boston; Presidente, Departamento de Cirurgia, Diretor, Adele R Decof Cancer Center, Roger Williams Medical Center N Joseph Espat, MD, MS, FACS é membro das seguintes sociedades médicas: Alpha Omega Alpha , American Association for Cancer Research , American College of Surgeons , American Medical Association , American Society for Parenteral and Enteral Nutrition , American Society of Clinical Oncology , Americas Hepato-Pancreato-Biliary Association , Association for Academic Surgery, Central Surgical Association , Chicago Medical Society , International Hepato-Pancreato-Biliary Association , Pancreas Club , Sigma Xi, The Scientific Research Honor Society , Society for Leukocyte Biology , Society for Surgery of the Alimentary Tract , Society of American Gastrointestinal and Endoscopic Surgeons , Society of Surgical Oncology , Society of University Surgeons , Southeastern Surgical Congress , Southern Medical Association , Surgical Infection Society Colaboradores Adicionais
Robert C Shepard, MD, FACP Professor Associado de Medicina em Hematologia e Oncologia na Universidade da Carolina do Norte em Chapel Hill; Vice-presidente de Assuntos Científicos, Especialização Terapêutica, Oncologia, na PRA International
Robert C Shepard, MD, FACP é membro das seguintes sociedades médicas: American Association for Cancer Research , American Association for Physician Leadership , European Society for Medical Oncology , Association of Profissionais de Pesquisa Clínica , Federação Americana de Pesquisa Clínica , Eastern Cooperative Oncology Group , Society for Immunotherapy of Cancer ,Associação Americana de Informática Médica , Colégio Americano de Médicos , Federação Americana de Pesquisa Médica , Associação Médica Americana , Sociedade Americana de Hematologia , Sociedade Médica de Massachusetts
Fabian M Johnston, MD, MHS, FACS Professor Assistente, Departamento de Cirurgia, Escola de Medicina da Universidade Johns Hopkins
Fabian M Johnston, MD, MHS, FACS é membro das seguintes sociedades médicas: American Medical Association , National Medical Association , Society of Cirurgiões Acadêmicos Negros , Sociedade de Oncologia Cirúrgica
Nancy S Behazin, MD Fellow, Departamento de Gastroenterologia, Scott and White Hospital, Texas A&M Health Science Center College of Medicine
Nancy S Behazin, MD é membro das seguintes sociedades médicas: American College of Gastroenterology , American College of Physicians , American Medical Associação , Sociedade Americana de Endoscopia Gastrointestinal , Divulgação da Associação Médica do Texas